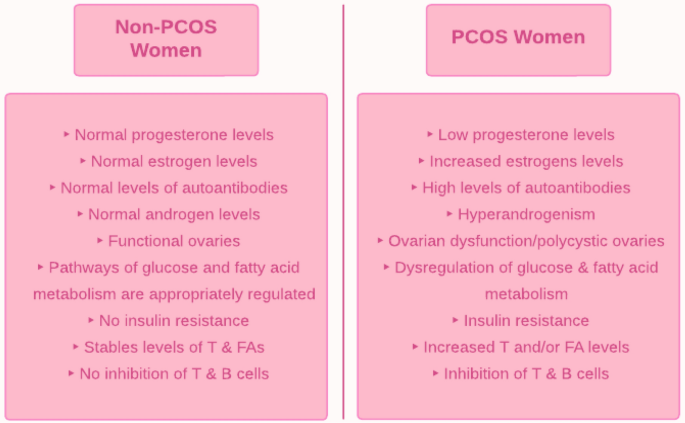
El síndrome de ovario poliquístico (SOP) es un trastorno metabólico-reproductivo-endocrino que, si bien tiene un componente genético, se sabe que tiene una etiología multifactorial compleja. Como el SOP es un diagnóstico de exclusión, se han desarrollado criterios estandarizados para su diagnóstico. El consenso general es que el hiperandrogenismo es la característica principal del síndrome de ovario poliquístico y se asocia con una serie de disfunciones fisiológicas; el exceso de andrógenos, por ejemplo, se ha correlacionado con la hipersecreción de citocinas, la proliferación de adipocitos y la desregulación de las vías de señalización. Otra característica clave del SOP es la resistencia a la insulina, lo que resulta en un metabolismo aberrante de la glucosa y los ácidos grasos.
Además, el sistema inmunológico juega un papel clave en el síndrome de ovario poliquístico. El hiperandrogenismo estimula algunas células inmunitarias mientras inhibe otras, alterando así el equilibrio normal de las células inmunitarias y creando un estado de inflamación crónica. Esta inflamación de bajo grado podría contribuir a la infertilidad ya que induce disfunción ovárica. Esta respuesta inmune desregulada en el síndrome de ovario poliquístico exhibe características de autoinmunidad que requieren más investigación.
Introducción. En las mujeres premenopáusicas, el síndrome de ovario poliquístico (SOP) es uno de los trastornos endocrino-metabólicos más comunes. Una paciente con síndrome de ovario poliquístico suele tener hiperandrogenismo y disfunción de los ovarios. La adiposidad abdominal, la obesidad y la resistencia a la insulina se asocian comúnmente con esta afección. Las mujeres con SOP tienden a tener ciclos menstruales prolongados y/o irregulares que conducen a infertilidad anovulatoria. A menudo son infértiles debido a la anovulación; si logran quedar embarazadas, tienen más probabilidades de sufrir complicaciones durante el embarazo, como abortos espontáneos o partos prematuros.
Si bien se desconoce la causa del síndrome de ovario poliquístico, se asocia con enfermedades cardiovasculares y diabetes mellitus tipo 2 (DM2), que provocan niveles elevados de andrógenos y resistencia a la insulina. Además, los pacientes con SOP pueden desarrollar una serie de complicaciones, incluido el síndrome metabólico, la depresión, la ansiedad, la apnea del sueño y el cáncer de endometrio.
Para el diagnóstico del SOP se han utilizado los Institutos Nacionales de Salud (NIH), la Androgen Society y los criterios de Rotterdam; los tres tienen el hiperandrogenismo como faceta central de sus criterios de diagnóstico Los criterios de Rotterdam son los más utilizados y los más aceptados.
Los criterios de Rotterdam establecen que se deben cumplir dos de los siguientes tres criterios para diagnosticar el síndrome de ovario poliquístico: hiperandrogenismo, ovarios poliquísticos detectados en la ecografía y oligo/anovulación. Para el diagnóstico se puede utilizar el hiperandrogenismo clínico y/o bioquímico; El hiperandrogenismo bioquímico está indicado por un aumento del índice de andrógenos libres (FAI) o niveles elevados de testosterona. Los pacientes con el fenotipo más metabólico de SOP tienen más probabilidades de tener hiperandrogenismo y oligo/anovulación. Como el síndrome de ovario poliquístico es un diagnóstico de exclusión, se deben excluir otras etiologías, como la disfunción tiroidea, los tumores secretores de andrógenos y la hiperprolactinemia, antes de poder realizar el diagnóstico.
Numerosos estudios han tenido como objetivo lograr una comprensión mecanicista más profunda del SOP, como su relación con el sistema inmunológico y cómo afecta las funciones corporales. Se sabe que varios factores clave subyacen a la fisiopatología del síndrome de ovario poliquístico. En primer lugar, existe una desregulación de las vías metabólicas, como las que son parte integral del metabolismo de la glucosa y los ácidos grasos. Esto, a su vez, conduce a complicaciones como la obesidad y la DM2. La obesidad se asocia con resistencia a la insulina e hiperinsulinemia, mientras que la DM2, por definición, se asocia con hiperglucemia.
Es crucial comprender la participación de los andrógenos en el sistema inmunológico, ya que los niveles de andrógenos están elevados en el síndrome de ovario poliquístico y la activación del sistema inmunológico estimula la producción de andrógenos. Además, el hiperandrogenismo en el síndrome de ovario poliquístico parece ser inmunosupresor porque inhibe varias células inmunitarias, como las células B y T. En cuanto a las demás células del sistema inmunológico, los estudios han sugerido la asociación de los andrógenos con los neutrófilos y las células dendríticas.
Las citoquinas, como el factor de necrosis tumoral alfa (TNF-ɑ), están influenciadas por los andrógenos. Además, varias interleucinas también parecen verse afectadas por los andrógenos, incluidas la interleucina-22 (IL-22), la interleucina-1α (IL-1α) y la interleucina-6 (IL-6). Por ejemplo, un estudio concluyó que cantidades elevadas de IL-1ɑ inhiben la secreción de estradiol.
Además, el SOP está estrechamente asociado con varias otras vías en el cuerpo, como la vía del factor de crecimiento transformante β (TGFβ), la vía de la quinasa AKT/PI3, la cascada MAPK y la vía JNK/ERK. vía. A través de varios estudios, se ha sugerido que estas vías están relacionadas con el hiperandrogenismo en el síndrome de ovario poliquístico. En los pacientes con síndrome de ovario poliquístico, los adipocitos producen cantidades de andrógenos superiores a la media. Los andrógenos no sólo dañan los adipocitos, sino que también estimulan la secreción de células esteroidogénicas. Los estudios han sugerido que las anomalías en las células esteroidogénicas contribuyen a la hipersecreción de andrógenos en el síndrome de ovario poliquístico. Además, el hiperandrogenismo del SOP conduce a cantidades más significativas de tejido adiposo abdominal tanto en mujeres con SOP obesas como con peso normal. Además, existe un aumento del estrés oxidativo (OS) presente en las mujeres con SOP, lo que contribuye a la obesidad y la resistencia a la insulina.
Esta revisión analiza la asociación de los andrógenos con las vías metabólicas, las células inmunitarias y su papel en el síndrome de ovario poliquístico. Hemos resumido exhaustivamente estas relaciones, incorporando la literatura más actualizada y hemos proporcionado más ideas para explorar la conexión entre el sistema inmunológico y el síndrome de ovario poliquístico.
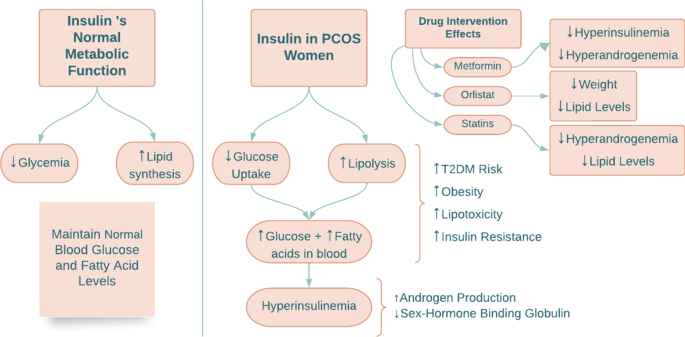
Desregulación de las vías metabólicas en el síndrome de ovario poliquístico. Las vías metabólicas de la glucosa y los ácidos grasos están conectadas mediante la acción de la insulina. El efecto de la insulina sobre el metabolismo de la glucosa se produce mediante la inhibición de la gluconeogénesis y la glucogenólisis, lo que da como resultado una disminución de los niveles circulantes de glucosa. La insulina también aumenta la síntesis de lípidos e inhibe la lipólisis al suprimir la lipasa sensible a hormonas. Sin embargo, en las mujeres con SOP, los primeros pasos en la vía de la insulina, como la alta absorción de glucosa y la inhibición de la lipólisis, disminuyen, lo que resulta en un aumento de los niveles de glucosa y ácidos grasos en la circulación (Fig. 1).
La hiperinsulinemia y la resistencia a la insulina son características estándar de las mujeres con SOP; estos podrían deberse principalmente a la genética o ser secundarios a la obesidad. El riesgo de DM2 por obesidad puede aumentar debido a la resistencia a la insulina y al fenotipo metabólico. Los ácidos grasos libres se acumulan en los tejidos debido al aumento de la lipólisis, lo que provoca resistencia a la insulina y lipotoxicidad. En un estudio realizado por Whigham et al., un análisis del aliento indicó una disminución de la oxidación de lípidos en mujeres con SOP en comparación con mujeres sin SOP, lo que sugiere que las mujeres con SOP tienen dificultades para cambiar de la oxidación de glucosa a la oxidación de lípidos. Esto enfatiza que estas mujeres tienen reservas de lípidos que no se utilizan, lo que contribuye a la obesidad y la DM2.
Fig. 1 A schematic summarizing insulin action in PCOS. T2DM type two diabetes mellitus
Los niveles de insulina y andrógenos están correlacionados positivamente: los niveles altos de insulina dan como resultado niveles elevados de andrógenos. La insulina actúa como cogonadotropina al aumentar la producción de andrógenos por parte de las células de la teca ovárica. También aumenta la sensibilidad de la corteza suprarrenal a la hormona adrenocorticotrópica (ACTH), aumentando aún más los niveles de andrógenos.
En un estudio de Baptiste et al. en mujeres obesas con síndrome de ovario poliquístico, la reducción de la cantidad de insulina con diazóxido dio como resultado un aumento de los niveles de globulina transportadora de hormonas sexuales (SHBG). Esto implica que la insulina inhibe la secreción de SHBG del hígado, lo que da como resultado altos niveles de andrógenos libres, y explica por qué las mujeres obesas con síndrome de ovario poliquístico con hiperinsulinemia tienen niveles bajos de SHBG. Estos resultados no sólo se observan en mujeres obesas con SOP, sino también en mujeres con SOP delgadas y normoinsulinémicas. Después de la administración de diazóxido en mujeres con SOP, sus altos niveles de andrógenos libres disminuyeron debido a la supresión de la insulina. Sin embargo, la reducción de los niveles de insulina mediante diazóxido en mujeres no obesas y sin síndrome de ovario poliquístico no influyó en los niveles de andrógenos. Esto implica que, independientemente de si una mujer con SOP es obesa/delgada o tiene niveles de insulina altos/normales, la acción de la insulina afecta directamente los niveles de andrógenos.
En un estudio realizado por Kuang et al., se investigó cómo la vía de señalización de la insulina en mujeres con SOP se ve afectada por las citocinas inflamatorias séricas y la berberina. Las citocinas se estudiaron en células (tratadas con berberina, un agente sensibilizador de la insulina) de 78 mujeres infértiles que se sometieron a fertilización in vitro (FIV). IL-1ɑ, IL-6 e IL-17ɑ estaban elevadas en el grupo con SOP, lo que provocó que las mujeres con SOP se encontraran en un estado inflamatorio subclínico prolongado. Debido a estos niveles elevados de interleucinas, se alteran la ovulación y la fertilización regulares, junto con el metabolismo de los glicolípidos, y se promueve la resistencia a la insulina, todo lo cual contribuye a las perturbaciones metabólicas observadas en el síndrome de ovario poliquístico. La berberina mejora la sensibilidad de la insulina y aumenta la captación de glucosa en mujeres con SOP al modular el sustrato 1 del receptor de insulina, ejerciendo así un efecto modulador sobre el SOP.
La metformina y la rosiglitazona, dos fármacos sensibilizadores a la insulina, tienen un impacto positivo en el estado metabólico e hiperandrogénico de las mujeres con síndrome de ovario poliquístico. En un estudio de Baptiste et al., ambos fármacos se utilizaron en mujeres no obesas con SOP, lo que demuestra que incluso en mujeres con SOP que no son obesas y tienen niveles normales de insulina, la hiperandrogenemia está relacionada con la resistencia a la insulina. La metformina redujo los niveles de insulina por debajo de lo normal al disminuir la producción de glucosa en el hígado y reducir los niveles altos de andrógenos, disminuyendo así la incidencia de DM2 en pacientes con SOP. Se prescribe con una dosis inicial de 500 a 850 mg por día que puede aumentarse a 2000 mg según sea necesario. La rosiglitazona, un agonista de PPARγ, también redujo los niveles de andrógenos sin cambiar los niveles de insulina, lo que sugiere que los agonistas de PPARγ pueden amortiguar la hiperreactividad de los andrógenos a la insulina.
En un ensayo controlado aleatorio se utilizaron medicamentos para bajar de peso, como orlistat, para comparar su eficacia con la metformina y el ejercicio. En el estudio, noventa mujeres obesas con SOP fueron asignadas aleatoriamente a tres grupos de tratamiento. Dos grupos recibieron orlistat o metformina más intervención en el estilo de vida, y a un grupo se le asignó sólo intervención en el estilo de vida. Orlistat y metformina redujeron el peso, la circunferencia de la cintura y el índice de masa corporal; sin embargo, orlistat tuvo menos efectos secundarios y mejoró los perfiles lipídicos. Por lo tanto, ambos fármacos afectaron positivamente la pérdida de peso y la ovulación, pero el orlistat tuvo menos efectos secundarios y fue mejor tolerado que la metformina.
Las estatinas, fármacos reductores del colesterol ampliamente recetados, se utilizaron en un estudio de tres meses en mujeres con síndrome de ovario poliquístico, logrando una disminución significativa de la hiperandrogenemia y los niveles de lípidos. En otro estudio sobre estatinas, en el que se compararon doce ensayos diferentes, los resultados mostraron una reducción general de la testosterona y otras hormonas andrógenas, así como de las lipoproteínas de baja densidad. Además, las estatinas normalizan la proporción de la hormona folículo estimulante (FSH) y la hormona luteinizante (LH), que promueve la producción de estrógeno sobre la testosterona, permitiendo así la maduración y liberación de los folículos. Sin embargo, existen preocupaciones sobre el uso de estatinas en mujeres premenopáusicas, ya que se sabe que son teratogénicas y tienen efectos contradictorios sobre la glucosa; algunos estudios muestran una reducción en los niveles de insulina después de la administración de estatinas, mientras que otros muestran una asociación con la hiperinsulinemia. Se requiere más investigación para determinar la estrategia terapéutica óptima para el uso de estatinas en el síndrome de ovario poliquístico.
Relación del hiperandrogenismo con la respuesta inmune en el síndrome de ovario poliquístico. Un aspecto clave del SOP es la participación del sistema inmunológico en su fisiopatología. El hiperandrogenismo afecta a los subtipos de células inmunitarias de diferentes maneras, pero en general, los niveles excesivos de andrógenos en el cuerpo estimulan ciertos tipos de células inmunitarias, como los neutrófilos, mientras que otras, como las células dendríticas, son inhibidas por el hiperandrogenismo. Estas células inmunitarias, a su vez, producen una amplia gama de citocinas que contribuyen a muchas de las características del síndrome de ovario poliquístico.
La naturaleza del síndrome de ovario poliquístico depende en última instancia de la interacción entre la actividad del sistema inmunológico y los niveles de andrógenos. Gleicher et al. optaron por evitar medir la reserva ovárica (OR) de las mujeres, que definieron como la "suma de todos los folículos restantes", ya que incluía una gran cantidad de folículos que en realidad no crecen. En cambio, optaron por estudiar la reserva ovárica funcional (FOR), que se refiere a "el conjunto de pequeños folículos en crecimiento".
En este estudio, los sujetos se dividieron en tres grupos: mujeres con una disminución de FOR dependiente de la edad, mujeres con una disminución prematura de FOR y controles con FOR normal, y se evaluaron los niveles de activación inmune y andrógenos. El hallazgo clave fue que los controles con FOR normal, que principalmente también mostraban una mayor activación del sistema inmunológico, tenían mayores cantidades de testosterona en comparación con las mujeres con FOR disminuido. Los niveles más bajos de testosterona en mujeres con FOR disminuido también pueden deberse a un menor número general de células de la teca, lo que indica una producción reducida de andrógenos. Los autores explicaron estos hallazgos sugiriendo que las mujeres con FOR normal tenían niveles elevados de andrógenos porque la magnitud de la actividad de su sistema inmunológico se correlacionaba positivamente con la producción de un factor productor de andrógenos (APF) [7]. Como resultado, en mujeres con FOR disminuido, la función inmune disminuida se asocia con niveles disminuidos de APF, lo que a su vez se correlaciona con niveles disminuidos de andrógenos.
Basado en la sugerencia de que la función del sistema inmunológico estimula la síntesis de andrógenos, los andrógenos tendrían que ser inmunosupresores para funcionar como parte de un proceso de retroalimentación negativa, regulando así los niveles de andrógenos. Utilizando este modelo de producción de andrógenos estimulada por la activación inmune para explicar el SOP, los autores sugirieron que los autoanticuerpos inducidos por la inflamación en el SOP conducen a una activación excesiva del sistema inmunológico que, a su vez, resulta en una mayor síntesis de APF y el consiguiente hiperandrogenismo. Según Hu et al., la relación entre el estado inflamatorio y la producción de autoanticuerpos en el síndrome de ovario poliquístico se puede explicar considerando que la inflamación se asocia con niveles elevados de células inmunes proinflamatorias y la inhibición de células antiinflamatorias; este "desequilibrio del microambiente inmunológico" impulsa la producción de autoanticuerpos. Ciertos estudios también han investigado el efecto de los andrógenos en tipos específicos de células inmunes, que se clasifican en células mieloides, linfoides y dendríticas.
Macrófagos en la patogénesis del síndrome de ovario poliquístico. En los ovarios y el tejido adiposo, los macrófagos son las células inmunitarias más abundantes y son necesarios para equilibrar la inmunidad mediada por células destructiva y protectora en la inflamación. Los niveles de macrófagos varían a lo largo del ciclo menstrual y son más altos durante la ovulación y la fase lútea; esto sugiere que los macrófagos están bajo la regulación hormonal de la progesterona.
Las mujeres con síndrome de ovario poliquístico suelen presentar obesidad y resistencia a la insulina, estados fisiopatológicos caracterizados por macrófagos que se convierten en un fenotipo proinflamatorio M1 a partir de un fenotipo antiinflamatorio M2. Los macrófagos M1 producen citoquinas inflamatorias, como IL-1, IL-6 y TNF-ɑ, que están presentes en niveles elevados tanto en el suero como en el líquido folicular de las mujeres con SOP. El hiperandrogenismo encontrado en el SOP probablemente resulta en la conversión de macrófagos al estado M1, aumentando los niveles de citocinas, amplificando así los síntomas del SOP, como la resistencia a la insulina, la producción de andrógenos y el desequilibrio en la secreción del eje hipotalámico-pituitario-ovárico.
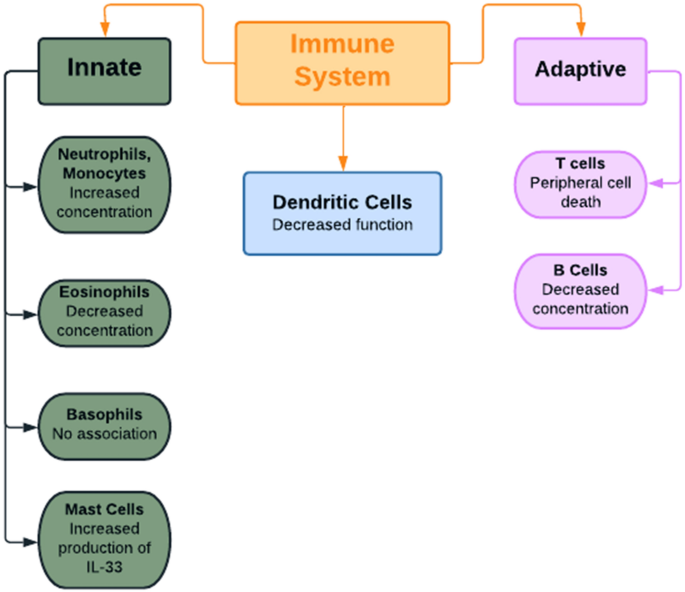
Neutrófilos y sus efectos en el síndrome de ovario poliquístico. Los andrógenos se asocian con una mayor tasa de producción de neutrófilos a partir de células precursoras mieloides; por lo tanto, a menudo se observa un exceso de neutrófilos (neutrofilia) en pacientes con SOP (Fig. 2). Este concepto está respaldado por un estudio que muestra la reducción de los niveles de neutrófilos tras la administración de 62,5 mg de flutamida, un fármaco antiandrógeno, durante 3 meses. El exceso de neutrófilos, a su vez, produce una amplia gama de citocinas, como TNF-ɑ, TGFβ, IL-6, IL-1α e IL-1β, que contribuyen a la fisiopatología del síndrome de ovario poliquístico. Además, los neutrófilos ingieren y destruyen las células muertas y defectuosas presentes en el exceso de grasa, lo que eventualmente resulta en una inflamación crónica de bajo grado.
Por lo general, el síndrome de ovario poliquístico se trata con píldoras anticonceptivas orales, que aumentan aún más los niveles de neutrófilos, aunque se sabe que la metformina trata trastornos inmunológicos y puede utilizarse para disminuir los niveles de neutrófilos.
Fig. 2 A summary of the effects of hyperandrogenism on different cell types of the innate and adaptive immune systems. IL-33 interleukin-33
Otras células mieloides asociadas con el síndrome de ovario poliquístico. Si bien los andrógenos se han asociado con niveles elevados de neutrófilos y monocitos, se han correlacionado con una disminución en la concentración de eosinófilos; esta relación se informó después de observar un aumento de eosinófilos después de una gonadectomía en ratones. Por el contrario, la testosterona no parece afectar el número de mastocitos, pero sí promueve la producción de IL-33 en los mastocitos, que, a su vez, impulsa la producción de basófilos y células linfoides innatas No se ha informado ninguna asociación entre basófilos y andrógenos. En general, parece que los andrógenos estimulan la rápida respuesta inmune no específica a los patógenos y, como consecuencia, el hiperandrogenismo en el síndrome de ovario poliquístico puede estar asociado con un aumento de la fagocitosis y otras funciones llevadas a cabo por el sistema inmunológico innato.
El papel del sistema del complemento en el síndrome de ovario poliquístico. Otro componente importante de la inmunidad innata es el sistema del complemento, que regula la inflamación a través de una serie gradual de proteínas conocida como cascada del complemento. La cascada del complemento tiene tres vías de activación: la vía clásica, la alternativa y la de lectinas. C3, un componente central, aumenta en pacientes con enfermedades metabólicas como la DM2. La vía terminal contiene el componente C5, que forma el complejo del complemento terminal (TCC).
En un estudio de casos y controles realizado por Lewis et al. al comparar los estados de ayuno y posprandial en pacientes con SOP y mujeres de control para establecer si el sistema del complemento estaba activado en pacientes con SOP, se determinaron las proteínas plasmáticas del complemento involucradas tanto en la vía de activación como en la terminal del complemento. C3, C3a (desArg), la relación C3a (desArg)/C3 y los niveles de TCC aumentaron en mujeres con SOP versus mujeres sin SOP y fueron particularmente altos en pacientes con SOP con obesidad y resistencia a la insulina. Curiosamente, los niveles de C3 y C3a(desArg) disminuyeron en respuesta al tratamiento con metformina y estatinas.
La relación entre andrógenos y células linfoides. Una gran cantidad de estudios han investigado la asociación entre los niveles de andrógenos y la actividad de las células B y T. Muchos estudios concluyeron de manera similar que los andrógenos se correlacionan negativamente con los niveles de células B. Una gonadectomía en ratones, con una caída posterior en los niveles de andrógenos, estimula la producción de células B, mientras que la administración de andrógenos (testosterona o 5ɑ-dihidrotestosterona (DHT)) inhibe la síntesis de células B. También se encontraron resultados similares en sujetos humanos; un nivel alto de testosterona en los hombres se asoció con una función baja de las células B y una producción inadecuada de anticuerpos. Se sugirió que los niveles elevados de andrógenos promueven la producción de TGFβ, que inhibe la interleucina-7 (IL-7) y, por lo tanto, se opone a la producción de células B. Por lo tanto, en mujeres con síndrome de ovario poliquístico, se esperaría que el hiperandrogenismo suprimiera la actividad de las células B. Como las células B producen IgM, el hiperandrogenismo inhibiría la síntesis de IgM, lo que daría como resultado una mayor susceptibilidad a la infección.
En cuanto al efecto de los andrógenos sobre la función de las células T, cabe destacar dos puntos clave. La deficiencia de testosterona se asocia con el crecimiento y agrandamiento del timo, mientras que un exceso de DHT promueve la muerte de las células T periféricas. Las células T desempeñan un papel en la inducción del crecimiento de células granulares y en la selección de folículos ováricos mediante la secreción de quimiocinas y factores de crecimiento; también promueven la apoptosis de las células de la granulosa mediante la liberación de agentes citotóxicos.
En un estudio realizado por Wu et al., se demostró que CD45RO + (células T de memoria) se correlacionan negativamente con los niveles de testosterona en las células de la teca de mujeres con SOP y controles. El grupo con SOP tenía niveles de andrógenos muy altos, lo que resultó en niveles muy bajos de CD45RO + , lo que promueve el desarrollo del SOP debido a una selección natural alterada de los folículos.
Aunque los andrógenos generalmente promueven la función del sistema inmunológico innato, parecen tener el efecto opuesto en el sistema inmunológico adaptativo, ya que los andrógenos inhiben la respuesta específica impulsada por anticuerpos a los patógenos, lo que resulta en una mayor susceptibilidad a la infección en el síndrome de ovario poliquístico. Además, se puede inferir que los pacientes con SOP también pueden tener una mala respuesta a una infección que ocurre por segunda vez debido a la mala función de las células B y a la alteración de la conversión en células de memoria.
El papel de las células T y los biomarcadores en la inflamación. Las células T colaboradoras (Th) dirigen señales inmunes proinflamatorias y antiinflamatorias [R]. La IL-12 impulsa la conversión de células T en células Th1, mientras que la IL-13 y la IL-14 convierten las células T en células Th2. Los andrógenos y el estradiol se correlacionan con la inflamación, ya que los niveles de IL-12 fueron significativamente mayores en el líquido folicular de las mujeres con SOP, mientras que los niveles de IL-13 disminuyeron según un estudio de Gallinelli et al.; esto daría como resultado un cambio a las células Th1. Además, debido a la gran cantidad de folículos sin ovulación en las mujeres con SOP, hay niveles elevados de estrógeno, que amplifican la secreción de citoquinas inflamatorias de las células Th1 como IL-6, TNF-α e interferón-y (IFN-γ). La IL-6 promueve la conversión de células Th0 en células Th17, que son proinflamatorias tanto en la sangre como en los riñones. En las mujeres con SOP es común una mayor divergencia entre el número de células Th17 y Th2, que se inclina significativamente hacia las células Th17.
Por lo tanto, hay niveles elevados de células Th1 y Th17 en pacientes con SOP, lo que conduce a una respuesta inmune excesiva; esto sugiere un origen autoinmune subyacente al desarrollo del síndrome de ovario poliquístico. Las células T reguladoras (Tregs) desempeñan un papel importante en la inhibición de enfermedades autoinmunes, por lo que su mal funcionamiento daría como resultado un mayor riesgo de padecer una enfermedad autoinmune. En pacientes con SOP, el número de Tregs disminuye en comparación con los controles en sangre periférica, por lo que la proporción Th17/Tregs aumentaría hacia Th17, lo que resulta en un estado inflamatorio crónico.
La inflamación es una de las causas subyacentes más probables del síndrome de ovario poliquístico, aunque generalmente se pasa por alto y es un hilo común que vincula la resistencia a la insulina, la DM2 y la obesidad. Para mantener la función ovárica normal, es esencial que los niveles de marcadores inflamatorios estén en equilibrio; Los diferentes niveles de citoquinas proinflamatorias y antiinflamatorias contribuyen a la disfunción ovárica y a la maduración folicular inadecuada. Los niveles anormales de citocinas, como TNF-ɑ, IL-6, IL-8, IL-10, IL-18, IL-33 y proteína C reactiva (PCR), provocan disfunción ovárica.
La PCR es el biomarcador más potente de inflamación en mujeres con SOP; un nivel alto de PCR indica un riesgo potencial de desarrollo de DM2 debido a una alta inflamación. La PCR también es un marcador importante de riesgo cardiovascular y puede usarse para predecir la posibilidad de enfermedad cardiovascular en pacientes con SOP. Los tratamientos para el síndrome de ovario poliquístico suelen centrarse en tratar problemas metabólicos y ovulatorios; sin embargo, tratar la inflamación crónica en mujeres con SOP ayudaría a modular los factores de riesgo metabólicos y reproductivos asociados.
El efecto del hiperandrogenismo sobre las células asesinas naturales. Las células asesinas naturales (NK) son células inmunes innatas derivadas de progenitores linfoides; no sólo matan microbios y células tumorales, sino que también regulan otras células inmunitarias, como las células dendríticas (DC) y los macrófagos. Las células NK uterinas son los linfocitos granulares CD3 − /CD56 + , que no se parecen a ninguno de los subtipos de NK en la sangre periférica y tienen una alta expresión de CD56. Los receptores de andrógenos suprimen la expresión de IL-12ɑ, lo que, a su vez, reduce la eficacia de las células NK.
En un estudio en el que se administró el antagonista del receptor de andrógenos sorafenib a 30 mg/kg de peso corporal en ratones durante 16 días, la función de las células NK mejoró. Las mujeres con síndrome de ovario poliquístico con niveles altos de andrógenos tienen una desregulación de citoquinas con niveles reducidos de IL-12ɑ, lo que resulta en el reclutamiento de menos células NK. Esto es importante porque este trastorno de citocinas, con niveles reducidos de IL-12ɑ, IL-15, IL-18 y CXCL10, perjudica la tolerancia fetal-materna y el mantenimiento del embarazo, ya que estas citocinas ayudan en el proceso de decidualización endometrial
La inhibición de las células dendríticas en el síndrome de ovario poliquístico. Se puede considerar que las células dendríticas (CD) son miembros tanto del sistema inmunológico adaptativo como del innato; tienen la capacidad fagocítica de procesar antígenos y presentarlos a las células T en los ganglios linfáticos. Son inflamatorias y producen citoquinas “como TNF-ɑ, IL-6, IL-11, IL-12 e IL-23, que, a su vez, inducen la proliferación de células T alogénicas y las diferencian a Th17 y Th1. subtipos”. La cantidad de CD en el líquido folicular en mujeres con SOP se reduce en comparación con las mujeres sin SOP debido al efecto negativo que los andrógenos tienen sobre las CD. Este hallazgo está respaldado por el hecho de que la gonadectomía en ratones macho promueve la síntesis de sustancias coestimuladoras y del complejo mayor de histocompatibilidad (MHC) para las células dendríticas, aumentando así la actividad de las células dendríticas.
Asimismo, los hombres con una condición hipogonadal demostraron una mayor actividad de las células dendríticas, lo que respalda aún más la influencia inmunosupresora de los andrógenos en las CD. El resultado son niveles inadecuados de CD para activar Th17 y Th1, lo que provoca un fallo en el desarrollo y la maduración del folículo ovárico. Como los andrógenos tienen un efecto inhibidor sobre las CD, las citocinas producidas por las CD se reducen en concentración; sin embargo, dado que los andrógenos también estimulan otras células inmunitarias que producen las mismas citocinas, la producción general de citocinas no se reduce. Además, los andrógenos estimulan niveles elevados de monocitos pero en realidad inhiben las células dendríticas; por lo tanto, es posible que una de las acciones de los andrógenos relacionadas con el sistema inmunológico esté favoreciendo la diferenciación de monocitos a macrófagos en lugar de células dendríticas.
Para resumir el efecto del hiperandrogenismo sobre la función inmune en el síndrome de ovario poliquístico, el exceso de andrógenos se asocia con una mayor actividad de los neutrófilos, una mayor función de los monocitos y una alta producción de IL-33 a partir de mastocitos. Sin embargo, hay una concentración disminuida de eosinófilos, actividad suprimida de las células B y T e inhibición de la función de las células dendríticas. Estos cambios en los niveles de células inmunitarias dan como resultado cambios en las concentraciones de citocinas que contribuyen directamente a la fisiopatología que se observa comúnmente en el síndrome de ovario poliquístico.
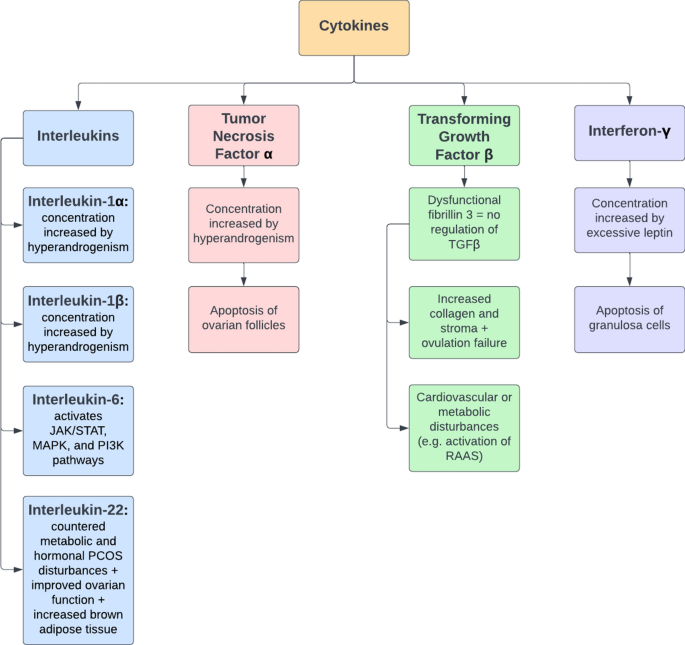
El efecto de los andrógenos sobre las citocinas. Como se señaló anteriormente, el hiperandrogenismo en el SOP afecta a las células inmunitarias de diferentes maneras, pero su función clave en el SOP es la producción de una amplia gama de citoquinas, incluidas TNF-ɑ, IL-1, IL-6 e IL-22. En el síndrome de ovario poliquístico, estas citocinas tienen efectos negativos en muchas funciones corporales y contribuyen a muchas de las características clínicas del síndrome de ovario poliquístico, como resistencia a la insulina, obesidad, hipertensión e infertilidad
El papel del factor de necrosis tumoral-ɑ (TNF-ɑ) en la infertilidad y la resistencia a la insulina.
Krishnan et al. investigaron la influencia del hiperandrogenismo en la síntesis de TNF-ɑ en seis ratas hembra. Para inducir niveles elevados de andrógenos, los investigadores utilizaron una bomba osmótica que secretaba 83 µg de DHT por día durante 90 días. Durante este período, se controlaron los niveles de TNF-ɑ, IL-1β, FSH, LH, cortisol y otras biomoléculas. Los resultados se compararon con seis ratas hembras de control con niveles normales de andrógenos. El hallazgo más pertinente fue que las ratas con hiperandrogenismo tenían niveles significativamente más altos de TNF-ɑ e IL-1β en comparación con las ratas control (Fig. 3). Además, los ovarios de las ratas que recibieron exceso de andrógenos eran más pequeños y tenían numerosos quistes que se asemejaban al síndrome de ovario poliquístico en las mujeres.
Al intentar explicar estos resultados, Krishnan et al. sugirieron que los andrógenos actúan como agentes proinflamatorios en el síndrome de ovario poliquístico al inducir el factor nuclear de las células T (NFAT5), que a su vez estimula la expresión de TNF-ɑ e IL-1β. En consecuencia, la concentración elevada de TNF-ɑ puede provocar apoptosis o atresia de los folículos ováricos. Estos hallazgos sugieren que el factor clave asociado con el exceso de TNF-ɑ es la hiperactivación de la transcripción genética; por lo tanto, puede resultar beneficioso desarrollar agentes terapéuticos que repriman la transcripción genética en este caso.
Fig. 3 The role of cytokines in the development of PCOS. RAAS renin–angiotensin–aldosterone system, TGFβ transforming growth factor β
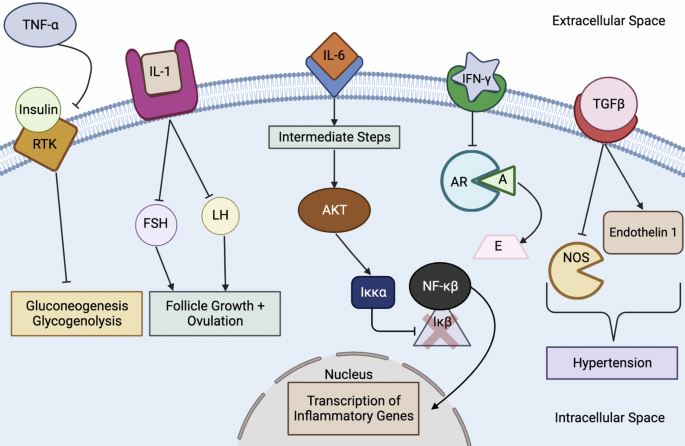
Como se mencionó anteriormente, el TNF-ɑ es producido por macrófagos M1, neutrófilos y células Th1, todos inducidos por el hiperandrogenismo en el síndrome de ovario poliquístico; como resultado, el aumento significativo de TNF-ɑ inhibe la función tirosina quinasa del receptor de insulina, lo que altera la vía de transducción de señales de la insulina y, en última instancia, conduce a la resistencia a la insulina que se observa en el síndrome de ovario poliquístico (Fig. 4). Además, investigaciones recientes han sugerido que los niveles altos de TNF-ɑ en el SOP podrían estimular el factor nuclear kappa B p65 (NF-κBp65) que, a su vez, inhibe el transportador de glucosa endometrial GLUT-4, lo que posiblemente contribuya a la hiperglucemia asociada al SOP
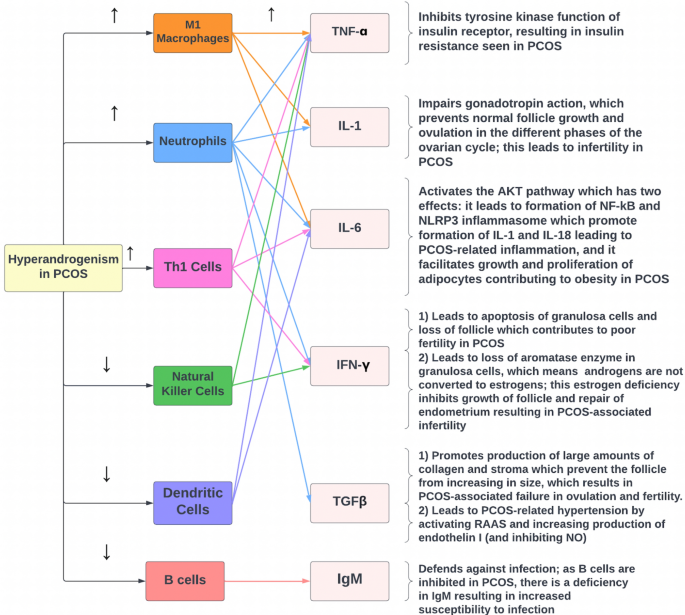
Fig. 4 The relationship between hyperandrogenism, the immune system, cytokines, and the features of PCOS. TNF-α tumor necrosis factor-α, IL interleukin, Th1 cells T helper 1 cells, NF-κβ nuclear factor-κβ, IFN-γ interferon-γ, TGFβ transforming
La relación entre la interleucina-1 (IL-1) y la infertilidad en el síndrome de ovario poliquístico. Cuando se analiza la influencia de los andrógenos sobre la IL-1, es importante considerar tanto la IL-1α como la IL-1β.
Zangeneh et al. realizó un estudio de casos y controles que implicó una comparación entre 85 casos (mujeres con SOP) y 86 controles (mujeres sanas sin SOP). Específicamente, la comparación implicó el análisis de las concentraciones sanguíneas de IL-1α, así como de otras citocinas. Los investigadores encontraron que las mujeres con SOP tenían una concentración sanguínea media de IL-1α de 401,40 pg/ml, mientras que el grupo de control tenía una media de sólo 19,32 pg/ml, concluyendo que el hiperandrogenismo se correlaciona positivamente con una mayor producción de IL. -1α, que a su vez inhibe la secreción de estradiol.
Al oponerse a la acción del estradiol, la IL-1α previene el desarrollo normal de los folículos y la reparación del endometrio después de la menstruación, lo que contribuye a la infertilidad que se observa típicamente en el síndrome de ovario poliquístico. El aumento del nivel de IL-1β media tanto en la síntesis de andrógenos como en el bloqueo de los efectos de las gonadotropinas (Fig. 5). Al contrarrestar las funciones de las gonadotropinas, la IL-1β altera el desarrollo del folículo y la ovulación de una manera que complementa las acciones de la IL-1α, contribuyendo a la infertilidad como se señaló anteriormente.
Dado que el hiperandrogenismo produce una mayor producción de macrófagos y neutrófilos M1, estos dos tipos de células producen mayores cantidades de IL-1α e IL-1β. Luego, ambas interleucinas inhiben en mayor medida la función de las gonadotropinas, inhibiendo la progresión normal de las fases folicular y lútea del ciclo ovárico y contribuyendo a la infertilidad asociada al síndrome de ovario poliquístico
Fig.5 Cytokine Signaling Cascade in PCOS. TNF-α tumor necrosis factor-α, RTK receptor tyrosine kinase, IL interleukin, FSH follicle-stimulating hormone, LH luteinizing hormone, Iκκα inhibitory κB-kinase alpha, NF-κβ nuclear factor-κβ, IκB inhibitory-κB, IFN-γ interferon-γ, AR aromatase enzyme, A androgens, E estrogens, TGFβ transforming growth factor β, NOS nitric oxide synthase
Popovic et al. utilizó un antagonista del receptor de IL-1, anakinra, administrado en 17 pacientes con SOP; los pacientes recibieron 100 mg de anakinra al día durante 28 días, después de lo cual se midieron los niveles de PCR y andrógenos. Los investigadores encontraron que anakinra redujo los niveles de PCR cuando se midieron los días 7, 21 y 28; Además, provocó un aumento de la concentración de estradiol, probablemente al eliminar el bloqueo de la acción de las gonadotropinas. Además, cinco sujetos con síndrome de ovario poliquístico que previamente eran oligomenorreicas o amenorreicas mostraron sangrado menstrual. Sin embargo, anakinra provocó un aumento de androstenediona, testosterona y DHT hasta el día 7. Esto sugiere que anakinra tiene beneficios terapéuticos potenciales para algunos de los síntomas del SOP inducidos por IL-1. Según este estudio, parece que la infertilidad en el síndrome de ovario poliquístico está directamente relacionada con la producción de IL-1β con la consiguiente inhibición de las gonadotropinas FSH y LH.
El papel de la interleucina-6 (IL-6) y sus vías de señalización en el síndrome de ovario poliquístico. Otra interleucina que desempeña un papel importante en el síndrome de ovario poliquístico es la IL-6, que puede funcionar mediante dos vías de señalización. En la vía antiinflamatoria clásica, la IL-6 se une al receptor de IL-6 (IL-6R) para formar un complejo con dos moléculas de glicoproteína 130 (gp130).
En la vía de transseñalización proinflamatoria, la IL-6 se acopla con la IL-6R, que luego se une a la gp130 en la membrana de una célula. Ambas vías pueden resultar en la activación de la vía JAK/STAT, la vía MAPK o la vía PI3K. Tanto la vía clásica como la de transseñalización dan como resultado la activación de STAT3, que luego puede trasladarse al núcleo para iniciar la transcripción como parte de la vía JAK/STAT; de hecho, este proceso JAK/STAT puede activar los procesos MAPK y PI3K. Respecto a la vía MAPK, la JAK fosforilada puede activar Ras reemplazando el guanosín difosfato (GDP) al que está unido por guanosín trifosfato (GTP); En consecuencia, este Ras activado activa Raf-1, que activa MAPK para que pueda translocarse al núcleo y comenzar la transcripción genética.
Por otro lado, la JAK fosforilada también puede inducir la vía PI3K activando PI3K, el agente que luego estimula la conversión de fosfatidilinositol 4,5-bifosfato (PIP2) en fosfatidilinositol (3,4,5)-trifosfato (PIP3) y, como resultado, induce el complejo PKB/AKT. Luego, el siguiente paso lo lleva a cabo AKT, una serina/treonina-proteína quinasa que también se conoce como proteína quinasa B (PKB); La función clave de AKT es inducir la fosforilación de proteínas dentro de la célula para controlar en última instancia múltiples actividades celulares En esta vía particular, AKT estimula la κB-quinasa alfa inhibidora (Iκκα), que descompone la κB inhibidora (IκB), una proteína inhibidora; esto elimina el bloqueo del factor nuclear κB (NF-κB) y le permite ingresar al núcleo. Una vez que el NF-κB ingresa al núcleo, promueve la transcripción de genes implicados en reacciones inflamatorias.
Además, la activación de NF-κB se correlaciona con la formación de la proteína NLRP3 que luego se une a la pro-Caspasa-1 y ASC para formar el inflamasoma NLRP3; este inflamasoma luego promueve la producción de IL-1β e IL-18, lo que en última instancia contribuye al estado inflamatorio en el síndrome de ovario poliquístico. NF-κB parece ser el regulador clave de los niveles de IL-6, ya que puede estimular e inhibir la producción de IL-6, y NF-κB ejerce esta función reguladora uniéndose a su sitio de unión en el cromosoma 7p21 o influyendo en la actividad. de STAT3.
Como se mencionó anteriormente, el hiperandrogenismo en el síndrome de ovario poliquístico promueve una mayor producción de células Th1 productoras de IL-6, neutrófilos y macrófagos M1; debido al aumento resultante en la concentración de IL-6, hay una mayor activación de la vía AKT, lo que contribuye a dos características del síndrome de ovario poliquístico. En primer lugar, da como resultado la formación del inflamasoma NLRP3, que desempeña un papel en la inflamación relacionada con el síndrome de ovario poliquístico. En segundo lugar, da como resultado un mayor crecimiento y proliferación de adipocitos, lo que puede provocar la obesidad que se observa en el síndrome de ovario poliquístico.
Los estudios han demostrado que el síndrome de ovario poliquístico se asocia con niveles elevados de IL-6 que pueden contribuir a la resistencia a la insulina. Como tal, ahora se están llevando a cabo investigaciones para identificar terapias que puedan controlar el síndrome de ovario poliquístico dirigiéndose y oponiéndose a la señalización de IL-6. Actualmente, los estudios están investigando la posibilidad de apuntar a IL-6, IL-6R, gp130 o JAK. Además, ciertos tratamientos como el té verde, la curcumina y la metformina han mostrado una disminución en los niveles de IL-6, por lo que también pueden ser áreas potenciales de exploración nutracéutica para opciones de tratamiento, con inhibición de la vía JAK/STAT que regula negativamente las vías PI3K y MAPK que afectan las tres vías de señalización utilizadas por la IL-6.
Otro aspecto importante del papel de la IL-6 es su interrelación con la cistatina-C. Investigaciones recientes sugieren una correlación positiva entre las concentraciones circulatorias de IL-6 y cistatina-C; aumento del nivel de cistatina-C. Los niveles predicen una mayor probabilidad de enfermedad cardiovascular, insuficiencia renal y mortalidad por todas las causas. Por lo tanto, la IL-6 puede tener un impacto directo en el desarrollo de complicaciones en el SOP, lo que la convierte en un objetivo potencialmente valioso para reducir la mortalidad en el SOP
El potencial terapéutico de la interleucina-22 (IL-22) en el síndrome de ovario poliquístico. La discusión sobre la interacción entre el SOP y las citocinas se puede complementar explorando el efecto terapéutico de la IL-22 y su capacidad para mediar las características del SOP.
Qi y col. investigaron los beneficios de la IL-22 estudiando tres grupos de ratones: un grupo de dehidroepiandrosterona (DHEA) que recibió altos niveles de DHEA, un grupo de DHEA+ IL-22 que recibió tanto DHEA como IL-22, y un grupo de control con niveles normales de andrógenos. En estos grupos, los ratones que recibieron DHEA recibieron 6 mg por 100 g de peso corporal durante 21 días, mientras que los ratones que recibieron IL-22 recibieron 100 µg por kilogramo de peso corporal durante otros 21 días.
Los investigadores resumieron el efecto de la IL-22 en cuatro puntos clave. En primer lugar, la IL-22 revirtió la disfunción metabólica en el síndrome de ovario poliquístico al reducir los niveles de glucosa en la prueba de tolerancia a la glucosa, además de restaurar la capacidad de respuesta normal a la insulina en la prueba de tolerancia a la insulina. En segundo lugar, la administración de IL-22 también contrarrestó las alteraciones hormonales al reducir tanto los niveles de testosterona como la relación LH/FSH, los cuales son altos en mujeres con SOP. En tercer lugar, la IL-22 también se asoció con una mejor función ovárica, lo que se puede observar en cómo los ratones que recibieron IL-22 tuvieron una mejor cantidad de cuerpos lúteos, una mayor producción de embriones y menos folículos quísticos. Finalmente, la IL-22 también contribuyó al oscurecimiento del tejido adiposo blanco, lo que desempeña un papel en la reversión de la disfunción del metabolismo de la glucosa. El hallazgo sobre la interacción entre la IL-22 y el tejido adiposo marrón también puede explicarse considerando que la función clave del tejido adiposo marrón es la generación de calor. Para producir calor, habría una mayor descomposición de la glucosa y una disminución resultante en los niveles de glucosa cuando se miden mediante la prueba de tolerancia a la glucosa, lo que explica cómo la IL-22 puede mejorar el metabolismo de la glucosa.
Interferón-γ y su efecto sobre la fertilidad en el síndrome de ovario poliquístico. Otra citocina clave implicada en la patogénesis del SOP es el IFN-γ, que parece estar asociado con la leptina.
Wang y cols. buscó identificar el papel de la leptina en el desarrollo del SOP y demostró que las mujeres con SOP tenían un nivel más alto de leptina que los sujetos de control. Wang y cols. también encontraron una correlación positiva entre el aumento de la cantidad de leptina y la evaluación del modelo homeostático para la resistencia a la insulina (HOMA-IR); Además, esta investigación también estableció la relación entre HOMA-IR y la respuesta inflamatoria controlada por Th1 (controlada por T helper tipo 1) que produce IFN-γ. Entonces, al combinar estas dos afirmaciones, parece que el exceso de leptina en el síndrome de ovario poliquístico se correlaciona directamente y positivamente con niveles elevados de IFN-γ. Como resultado, Wang et al. llegó a la conclusión de que el IFN-γ había aumentado la producción en mujeres con síndrome de ovario poliquístico bajo la influencia de la leptina. Lo que es interesante señalar es que, según estos hallazgos, la producción de IFN-γ puede contribuir a la producción de exceso de andrógenos en el síndrome de ovario poliquístico; Al estimular la apoptosis de las células de la granulosa, el IFN-γ elimina la enzima aromatasa en estas células y, por lo tanto, garantiza que la vía de síntesis de esteroides termine en andrógenos en lugar de estrógenos.
Dado que el hiperandrogenismo aumenta la producción de células Th1, también contribuye al aumento de la producción de IFN-γ por parte de estas células. Este exceso de concentración de IFN-γ tiene varios efectos en relación con el SOP. Primero, conduce a la apoptosis de las células de la granulosa, lo que resulta en la terminación del folículo. En segundo lugar, al eliminar las células de la granulosa, el IFN-γ también inhibe la enzima aromatasa dentro de estas células, que normalmente convierte los andrógenos en estrógenos. Por lo tanto, sin la función adecuada de esta enzima, la producción de estrógeno se inhibe y ya no es capaz de promover eficazmente el crecimiento de los folículos y reparar el endometrio después de la menstruación. Ambos efectos están asociados con la infertilidad en el síndrome de ovario poliquístico
Los múltiples efectos del factor de crecimiento transformante β (TGFβ) en la patogénesis del síndrome de ovario poliquístico. Otra citocina clave implicada en el síndrome de ovario poliquístico es el TGFβ, cuya vía de señalización disfuncional parece estar asociada con el desarrollo del síndrome de ovario poliquístico. En la señalización normal, el TGFβ secretado se une tanto a su propéptido como a las proteínas de unión a TGFβ latentes (LTBP); Luego, este complejo se une a la fibrilina o a la folistatina y permanece inactivo hasta que se necesita. Una vez necesario, se disocia del complejo con fibrilina o folistatina y se une a un receptor de TGFβ tipo II, fosforilando un receptor de tipo I. Esto da como resultado la fosforilación de un SMAD regulado por receptor, una proteína dentro de la célula, que se une a un coSMAD para eventualmente ingresar al núcleo y alterar la transcripción genética
Debido a que la fibrilina 3 es la fibrilina clave que se une al TGFβ para mantenerlo en un estado inactivo, numerosos estudios han intentado investigar si existe una relación entre el gen de la fibrilina 3 y el desarrollo fetal del síndrome de ovario poliquístico. Si la fibrilina 3 es defectuosa, el TGFβ ya no formará complejos en un estado inactivo y, en cambio, activará la actividad de los fibroblastos, lo que provocará cantidades excesivas de colágeno y estroma. Al investigar la asociación entre la expresión de fibrilina 3 y el síndrome de ovario poliquístico, un estudio concluyó que “dado que las fibrilinas son matrices estromales y que los compartimentos del estroma ovárico están alterados en mujeres con síndrome de ovario poliquístico, la expresión de fibrilina 3 en el ovario fetal en desarrollo, a través de la actividad de TGFβ para regular la formación y función del estroma podrían predisponer a un individuo al síndrome de ovario poliquístico en una etapa posterior de su vida”. Otro estudio realizado en monos con síndrome de ovario poliquístico encontró que muchos de los genes implicados en la señalización del TGFβ estaban reprimidos debido a que tenían promotores metilados. Por lo tanto, ambos estudios sugieren que tener anomalías genéticas contribuye a una señalización anormal de TGFβ que se asocia con el desarrollo fetal del síndrome de ovario poliquístico.
La desregulación del TGFβ puede conducir al desarrollo de cantidades excesivas de colágeno y estroma. Además, la neutrofilia en el síndrome de ovario poliquístico podría dar lugar a una mayor producción de TGFβ, que también tendría la misma influencia sobre el colágeno y el estroma. De cualquier manera, esta perturbación puede tener dos efectos principales. En primer lugar, puede dar lugar a la producción de cantidades anormalmente altas de andrógenos, lo que lleva al hiperandrogenismo patognomónico del síndrome de ovario poliquístico. En segundo lugar, el estroma excesivo puede impedir que el folículo aumente de tamaño y se desarrolle, lo que puede contribuir a una falla en la ovulación y a la infertilidad relacionada con el síndrome de ovario poliquístico.
La señalización anormal de TGFβ o la producción excesiva debido a la neutrofilia pueden afectar la función cardiovascular y metabólica en el síndrome de ovario poliquístico. La actividad excesiva del TGFβ puede estimular las células del músculo liso en las paredes de los vasos sanguíneos para producir colágeno, lo que se asocia con un mayor riesgo de aterosclerosis. El TGFβ también puede inducir a las células endoteliales a producir IL-6, lo que puede contribuir a la obesidad. El TGFβ puede contribuir a la hipertensión al inhibir la óxido nítrico sintasa y promover la síntesis de endotelina I, lo que finalmente resulta en la constricción de los vasos. La disfunción del TGFβ también puede activar el sistema renina-angiotensina-aldosterona (SRAA), que se asocia con un mayor riesgo de aterosclerosis y una disminución de la distensibilidad arterial; Al estimular el RAAS, el TGFβ también puede asociarse con hipernatremia en el síndrome de ovario poliquístico debido a las acciones de la angiotensina II y la aldosterona.
Para resumir la relación entre TGFβ y SOP, parece que el hiperandrogenismo contribuye a niveles elevados de neutrófilos que a su vez producen grandes cantidades de TGFβ. Esta alta concentración de TGFβ contribuye a la hipertensión que se observa en el síndrome de ovario poliquístico al inducir la endotelina I, inhibir el NO y activar el SRAA
Hallazgos contradictorios sobre las citocinas en el síndrome de ovario poliquístico. Aunque la investigación discutida anteriormente proporcionó evidencia de una asociación entre las diversas citocinas y el síndrome de ovario poliquístico, otros estudios contradicen los hallazgos. En un metanálisis, no se encontró una asociación significativa entre los polimorfismos de TNF-ɑ e IL-1β y el desarrollo de SOP. Con respecto a la IL-6, los investigadores sólo encontraron una asociación entre el polimorfismo de la IL-6 y el desarrollo del síndrome de ovario poliquístico en una comparación de homocigotos y un modelo alélico. Estos datos resaltan la necesidad de realizar más estudios definitivos y sólidos sobre el papel de las citocinas en el síndrome de ovario poliquístico.
El desacuerdo sobre la interacción entre andrógenos y citoquinas puede explicarse de dos maneras. En primer lugar, muchos de los estudios que sugieren la presencia de una correlación positiva entre el hiperandrogenismo y la actividad de las citoquinas se llevaron a cabo en ratas, por lo que puede darse el caso de que estas interacciones fisiológicas ocurran de manera diferente en los humanos. En segundo lugar, una interpretación de todos los hallazgos presentados hasta ahora puede ser que en realidad no se contradicen entre sí y pueden coexistir de la siguiente manera: aunque las interacciones entre TNF-ɑ o IL-1β y PCOS pueden no ser de origen genético, pueden surgir durante la vida de la hembra; en otras palabras, la asociación puede ser adquirida y no hereditaria.
El efecto de los andrógenos sobre las vías de señalización en el síndrome de ovario poliquístico. Los estudios han demostrado numerosas conexiones entre el síndrome de ovario poliquístico y varias vías que ocurren en el cuerpo. Estas vías incluyen la vía TGFβ, la vía quinasa AKT/PI3, la cascada MAPK y la vía JNK/ERK (Fig. 6). Por ejemplo, se ha sugerido que la desregulación de la vía TGFβ tiene un papel en la patogénesis del SOP, mientras que la vía de la quinasa AKT/PI3 parece estar sobreactivada en el endometrio de pacientes con SOP. Además, se sugiere que la cascada MAPK está regulada negativamente en el síndrome de ovario poliquístico, y la vía JNK/ERK tiene cierto control sobre la síntesis de andrógenos. En general, obtener una comprensión integral de cómo se asocian estas vías con el síndrome de ovario poliquístico podría brindar información sobre cómo controlar la afección de manera más efectiva.
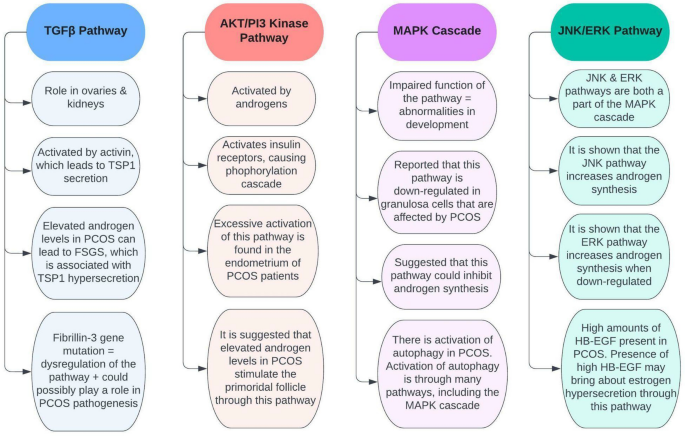
Fig. 6 The major pathways known to be involved in PCOS. TSP1 thrombospondin 1, FSGS focal segmental glomerulosclerosis, HB-EGF heparin-binding EGF-like growth factor
La vía del factor de crecimiento transformante β (TGFβ) en el síndrome de ovario poliquístico. La vía de señalización del TGFβ participa en varios procesos y tiene un papel crucial en los ovarios y los riñones. La activina activa esta vía, lo que a su vez da como resultado la liberación de la hormona FSH de los ovarios. En los riñones, la activina conducirá a la secreción de trombospondina 1 (TSP1), que desempeña un papel en la apoptosis y el crecimiento celular. En el síndrome de ovario poliquístico, el individuo tiene niveles elevados de andrógenos. Esto puede provocar daños en los receptores de andrógenos que se encuentran en el riñón, lo que a su vez puede provocar una serie de trastornos renales, como la glomeruloesclerosis focal y segmentaria (FSGS). Los andrógenos elevados dañan los podocitos en los riñones y provocan una hipersecreción de TSP1, que se asocia con la GEFS. Tanto el SOP como la FSGS están entrelazados ya que ambos están asociados con la vía de señalización del TGFβ.
La evidencia reciente ha demostrado que el síndrome de ovario poliquístico está relacionado con el gen de la fibrilina-3. Las fibrilinas y varias otras moléculas regulan la vía del TGFβ. Las mutaciones en este gen pueden dar lugar a una desregulación del TGFβ, que posiblemente podría desempeñar un papel en la patogénesis del síndrome de ovario poliquístico. La desregulación de esta vía da como resultado problemas cardiovasculares, metabólicos y reproductivos. Los problemas cardiovasculares incluyen la inflamación y la hiperactividad del RAAS. Los problemas metabólicos implican resistencia a la insulina, intolerancia a la glucosa y diabetes tipo 2. Los problemas reproductivos, por otro lado, incluyen la secreción anormal de gonadotropina, así como el hiperandrogenismo. Sin embargo, no hay evidencia suficiente para respaldar que la desregulación del TGFβ esté involucrada en la patogénesis del síndrome de ovario poliquístico. Se requiere más investigación, ya que la vía del TGFβ y el SOP están estrechamente asociados entre sí.
La vía de la fosfatidilinositol 3-quinasa (AKT/PI3) en el síndrome de ovario poliquístico. La vía de la quinasa AKT/PI3 está asociada con la vía de señalización de la insulina. Una vez que se activan los receptores de insulina, se produce una cascada de fosforilación. Esta cascada comienza debido a la autofosforilación de los receptores y a la activación de proteínas sustrato del receptor de insulina (como IRS-1 e IRS-2). Las proteínas sustrato luego inducirán a la PI3 quinasa a fosforilar PIP2 a PIP3 [32]. Esta vía está implicada en la división celular, el crecimiento celular, la supervivencia, el metabolismo, etc.
Se realizó un estudio para ver la activación de la vía de la quinasa AKT/PI3 en el endometrio en mujeres con síndrome de ovario poliquístico. Los participantes con SOP se dividieron en dos grupos: resistentes a la insulina y no resistentes a la insulina. Los resultados del estudio revelaron que la expresión de p-AKT (AKT fosforilada) era menor en el grupo sin resistencia a la insulina en comparación con el grupo resistente a la insulina, que tenía una mayor expresión de p-AKT. El estudio concluyó que había una activación excesiva de la vía de la quinasa AKT/PI3 en el endometrio de pacientes con SOP. Esta sobreactivación de la vía puede estar implicada en la hiperplasia endometrial, así como en el carcinoma.
La presencia de carcinoma de endometrio se puede investigar mediante pruebas tisulares para detectar exosomas que transporten ARN microsomal (miARN), como el miARN-21, que es un biomarcador valioso incluso en otras neoplasias malignas como el melanoma. El tratamiento y el curso de la enfermedad del carcinoma de endometrio se pueden investigar utilizando organoides endometriales, que son modelos de tejido in vitro. Además, la sobreactivación de esta vía en el endometrio puede provocar riesgo de resistencia a la insulina y obesidad en personas con síndrome de ovario poliquístico (Fig. 7). La vía de la quinasa AKT/PI3 es activada por andrógenos, como el estradiol. Dado que hay niveles elevados de andrógenos en pacientes con SOP, lo más probable es que esto provoque una sobreactivación de la vía. Esto implica que el hiperandrogenismo del SOP afecta directamente a la vía de la quinasa AKT/PI3.
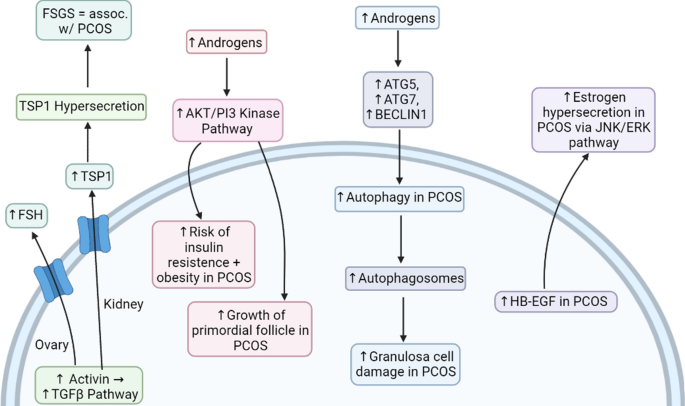
Fig. 7 The signaling pathways involved in the development of complications in PCOS. FSH follicle-stimulating hormone, TSP1 thrombospondin 1, FSGS focal segmental glomerulosclerosis, HB-EGF heparin-binding EGF-like growth factor
Los estudios sugieren que los niveles elevados de andrógenos en el síndrome de ovario poliquístico estimulan la activación del folículo primordial a través de la vía de la quinasa AKT/PI3. Esto se debe a que la testosterona activa la vía de la quinasa AKT/PI3, que a su vez activa el folículo primordial. Además, se plantea la hipótesis de que el hiperandrogenismo en el síndrome de ovario poliquístico da como resultado un mayor crecimiento de los folículos mediante la regulación positiva del factor de crecimiento similar a la insulina (IGF). Los IGF estimulan el desarrollo de los folículos y comúnmente están elevados en el SOP, y se sugiere que los IGF elevados son una posible causa del crecimiento acelerado de los folículos en los ovarios de las mujeres con SOP. Además, se ha demostrado que el hiperandrogenismo disminuye la expresión de la proteína Cx43 en las células de la granulosa. Esto sugiere que el exceso de andrógenos en el síndrome de ovario poliquístico podría posiblemente obstaculizar la forma en que se comunican las células de la granulosa, lo que provocaría una disfunción en la ovulación, así como una disfunción en el desarrollo de los folículos.
La cascada de proteína quinasa activada por mitógenos (MAPK) en el síndrome de ovario poliquístico. La cascada MAPK es una serie de vías que regulan varios procesos, como la apoptosis, la división y diferenciación celular, así como las respuestas al estrés. La función alterada de la cascada MAPK puede provocar anomalías en el desarrollo y también se asocia con la progresión de numerosas afecciones médicas.
Un estudio informó que la cascada MAPK está regulada negativamente en las células de la granulosa afectadas por el síndrome de ovario poliquístico. Por supuesto, esto afectaría las funciones de las células de la granulosa. Mediante un estudio se ha demostrado que la inhibición de la cascada MAPK en las células de la granulosa da como resultado la expresión de la enzima CYP17. Esta enzima participa en la síntesis de andrógenos. Además, la mayoría de los estudios han demostrado que la expresión de la proteína StAR aumenta en el síndrome de ovario poliquístico. La proteína StAR también participa en la síntesis de andrógenos. Estos estudios sugieren que la cascada MAPK podría reducir la expresión de la proteína StAR y de la enzima CYP17, lo que inhibiría la síntesis de andrógenos Sin embargo, hay algunos estudios que lo contradicen y se necesitan más investigaciones para aclararlo.
Un estudio ha demostrado que existe una activación de la autofagia en el síndrome de ovario poliquístico. La autofagia es el proceso que realiza el cuerpo para eliminar células dañadas, orgánulos, patógenos, etc. Desempeña un papel importante en el desarrollo. La activación de la autofagia se produce a través de varias vías, una de las cuales es la cascada MAPK. Una posible causa de la apoptosis de las células de la granulosa es la acumulación de autofagosomas. El hiperandrogenismo en el síndrome de ovario poliquístico podría resultar en la expresión de varios genes que inducen la autofagia, como ATG5, ATG7 y BECLIN1. Sin embargo, todavía existe una disputa sobre la activación de la autofagia en el síndrome de ovario poliquístico, por lo que se requiere más investigación. Dejando a un lado esta controversia, es posible que el exceso de andrógenos en el síndrome de ovario poliquístico pueda acelerar el proceso de autofagia, aumentando así la cantidad de autofagosomas acumulados. Por tanto, los niveles elevados de andrógenos podrían provocar la apoptosis de las células de la granulosa.
La vía de la quinasa c-Jun N-terminal (JNK)/quinasa regulada por señales extracelulares (ERK) en el síndrome de ovario poliquístico. Las vías JNK y ERK son parte de las vías involucradas en la cascada MAPK. Ayudan en la regulación de la apoptosis y también participan en muchos procesos celulares. Una de las principales enzimas en la síntesis de andrógenos es la citocromo p450 17ɑ-hidroxilasa (P450c17). En las mujeres con SOP, la actividad de esta enzima es bastante alta, lo que es una de las principales causas de hiperandrogenismo en el SOP. Por tanto, los cambios en esta enzima afectarán la producción de andrógenos.
Si bien se afirmó anteriormente en un estudio que la cascada MAPK está regulada a la baja en el síndrome de ovario poliquístico, otros hallazgos han descubierto que no es tan simple. Otros estudios han demostrado que la vía JNK (que forma parte de la cascada MAPK) se amplifica en el síndrome de ovario poliquístico. Además, algunos estudios han demostrado que la vía ERK específicamente podría aumentar la síntesis de andrógenos cuando se regula a la baja. Además, los hallazgos han demostrado que la vía JNK está involucrada en la estimulación de P450c17 y posiblemente podría explicar los niveles elevados de andrógenos en el síndrome de ovario poliquístico, ya que esta vía está potenciada en esta afección. Se puede deducir que no todas las vías de la cascada MAPK funcionan de la misma manera. Se ha demostrado que la vía JNK aumenta la síntesis de andrógenos, mientras que la vía ERK solo aumenta la síntesis de andrógenos cuando se reduce. Se puede concluir que la vía ERK está regulada negativamente en el síndrome de ovario poliquístico, lo que contribuye a niveles elevados de andrógenos. Por otro lado, es posible que la vía JNK no esté regulada negativamente en el síndrome de ovario poliquístico, lo que da como resultado la síntesis de andrógenos y, por lo tanto, posiblemente también contribuya al hiperandrogenismo.
Efectos de los andrógenos sobre los adipocitos y la producción de esteroides en el síndrome de ovario poliquístico. Los andrógenos son producidos por el tejido adiposo de los ovarios y las glándulas suprarrenales a partir del precursor común, el colesterol. El colesterol, a su vez, permite que se produzca la vía esteroidogénica. Por lo tanto, es importante comprender la síntesis regular de esteroides en humanos (Fig. 8). La vía esteroidogénica involucra varias proteínas y enzimas que producen hormonas esteroides activas.
El colesterol de la membrana mitocondrial externa se transloca a la membrana mitocondrial interna mediante la proteína reguladora aguda esteroidogénica (StAR). A continuación, el colesterol se convierte en pregnenolona mediante la escisión de la cadena lateral del citocromo p450, codificada por el gen CYP11A, en una reacción limitante de la velocidad. Luego, la pregnenolona se puede hidroxilar en 17ɑ-hidroxipregnenolona mediante P450C17, que también puede utilizar la actividad liasa para convertir 17ɑ-hidroxipregnenolona en DHEA. P450C17 se encuentra en las células de la teca de los ovarios y es importante para determinar si se producen andrógenos o progestágenos a partir de la vía esteroidogénica.
La pregnenolona también se puede convertir en progesterona mediante la 3 β-hidroxiesteroide-Δ5-esteroide deshidrogenasa de tipo II (3βHSDII). La progesterona se puede convertir en androstenediona (A4) mediante P450C17. La DHEA también puede producir A4 a través de 3 β HSDII, que luego se convierte en testosterona (T) mediante la 17 β-hidroxiesteroide deshidrogenasa. Estas reacciones ocurren en las células de la teca ovárica y permiten que las células de la granulosa absorban A4 y T. En las células de la granulosa, A4 y T se convierten en estrógeno mediante la enzima aromatasa citocromo P450, que está controlada por FSH. La T puede convertirse en DHT mediante la 5ɑ-reductasa en los tejidos periféricos. Varios estudios sugieren que las mujeres con SOP presentan niveles elevados de A4 y T.
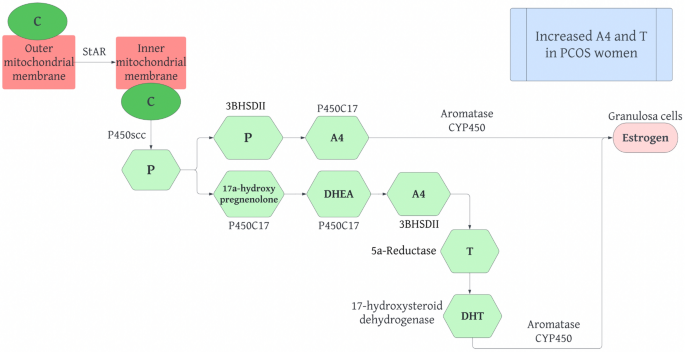
Fig. 8 The normal steroidogenesis pathway in humans. C Cholesterol, StAr Steroidogenic Acute Regulatory Protein, P450scc Cholesterol side-chain cleavage enzyme, P Progesterone, 3 β HSD II Type II 3-hydroxysteroid-5-steroid dehydrogenase, P450C17 Cytochrome p450 17ɑ-hydroxylase, A4 Androstenedione, DHEA Dehydroepiandrosterone, T Testosterone, DHT 5ɑ-dihydrotestosterone
En el síndrome de ovario poliquístico, los andrógenos tienen efectos nocivos sobre la función del tejido adiposo. La influencia de los andrógenos sobre la función de los adipocitos está determinada por los niveles de andrógenos circulantes, la “densidad y afinidad del receptor de andrógenos” y la actividad enzimática de los esteroides locales. La capacidad de los adipocitos para modular la actividad de las enzimas esteroidogénicas es de particular importancia en la progresión del hiperandrogenismo en el síndrome de ovario poliquístico debido a la conversión de andrógenos débiles en andrógenos fuertes. Por esta razón, la interrelación del hiperandrogenismo y la obesidad en mujeres con SOP puede originarse por un aumento de la esteroidogénesis de los adipocitos.
Con respecto a los receptores de andrógenos, que están presentes tanto en los preadipocitos como en los adipocitos maduros, los andrógenos pueden afectar la expresión genética, la diferenciación y proliferación celular, “y el metabolismo de los carbohidratos y lípidos”. Los andrógenos también aumentan la transcripción de los receptores de andrógenos en las células mononucleares, lo que permite la liberación de adipocitocinas, y la concentración de adipocitocinas aumenta aún más mediante la producción por parte de las células inmunitarias. Las adipocitoquinas, a su vez, estimulan la secreción de células esteroidogénicas. Esto se observa en el hiperandrogenismo del síndrome de ovario poliquístico, que permite la secreción anormal de adipocitocinas.
Estudios convincentes indican que las anomalías en las células esteroidogénicas de las células de la teca de los ovarios pueden provocar una sobreproducción de andrógenos en mujeres con síndrome de ovario poliquístico. De Mederios et al. publicó una revisión en 2021 sobre la “interrelación entre los adipocitos y las células esteroidogénicas suprarrenales y ováricas en modelos animales y humanos con o sin síndrome de ovario poliquístico”. Utilizando artículos publicados en PubMed tanto en inglés como en portugués, los investigadores encontraron que "los glucocorticoides y esteroides sexuales" regulan la diferenciación y función de los adipocitos, lo que resulta en tejido adiposo disfuncional tanto en animales como en mujeres. El estudio destacó que "las mujeres con síndrome de ovario poliquístico secretan niveles desequilibrados de adipocitos", específicamente cantidades mayores de leptina y cantidades reducidas de adiponectina. "La leptina se correlaciona positivamente con el índice de masa corporal, el índice cintura-cadera, los niveles de colesterol total, triglicéridos, LH, estrógeno y andrógenos".
Como se mencionó anteriormente, el exceso de leptina también se correlaciona positivamente con el IFN-γ. El IFN-γ controla la actividad enzimática de la 17ɑ-hidroxilasa y la aromatasa en las células de la granulosa, lo que hace que la vía de la esteroidogénesis termine con una mayor producción de andrógenos en lugar de estrógenos. Esta asociación entre la leptina y el IFN-γ refuerza la interacción del SOP, los andrógenos y el sistema inmunológico. "La adiponectina se correlaciona negativamente con el índice de masa corporal, el índice cintura-cadera, la glucosa, la insulina, los triglicéridos y los andrógenos". La producción de andrógenos disminuye a través de la enzima de la cadena lateral del colesterol, la 17ɑ-hidroxilasa, los receptores de LH y StAR.17 Existe una correlación positiva entre la resistina y la testosterona, la expresión de 17ɑ-hidroxilasa en las células de la teca y el índice de masa corporal
El estudio de 2022 realizado por De Medeiros et al. revisó estudios publicados de 1983 a 2021. Los investigadores destacaron que los andrógenos en los receptores de andrógenos actúan como factores de transcripción que modulan la expresión genética, que está controlada por varios factores, incluido el “receptor gamma activado por el proliferador de peroxisomas y la cascada de proteína quinasa activada por mitógenos”. Los investigadores transmitieron que los andrógenos reprimen epigenéticamente la diferenciación de los adipocitos a través de una transcripción reducida del receptor gamma activado por el proliferador de peroxisomas. En consecuencia, la inhibición de la diferenciación y maduración de los preadipocitos es modulada por T y DHT en los depósitos de tejido adiposo subcutáneo y visceral.
Los receptores de andrógenos también suprimen la expresión de IL-12ɑ para disminuir la eficiencia de las células NK. Los niveles elevados de T también estimulan la hipertrofia de los adipocitos y la producción excesiva de adipocitocinas. En mujeres con y sin síndrome de ovario poliquístico, cantidades elevadas de T inspiran la lipogénesis; sin embargo, existe una lipólisis alterada en mujeres no obesas con síndrome de ovario poliquístico. En términos de diferenciación anormal y proliferación del tejido adiposo, el tejido graso se reorganiza desde depósitos subcutáneos a viscerales. Como resultado, el hiperandrogenismo en mujeres con SOP conduce a una mayor adiposidad centralizada. Esto provoca una mayor cantidad de grasa localizada en el tronco en mujeres obesas y de peso normal con síndrome de ovario poliquístico.
Las anomalías en la vía de síntesis de esteroides pueden contribuir a la alteración de la actividad de las células inmunitarias y, por tanto, a irregularidades en la secreción de adipocitocinas, como se analizó anteriormente. En resumen, el aumento de las concentraciones de T se asocia con un FOR normal, lo que permite una mayor activación del sistema inmunológico y la producción de APF. El aumento de la producción de andrógenos provoca la conversión de macrófagos al estado M1, lo que permite una mayor liberación de citoquinas, neutrofilia y una mayor producción de monocitos.
Los andrógenos también influyen en los mastocitos para sintetizar IL-33, lo que conduce a la producción de basófilos y células linfoides innatas. El aumento de las concentraciones de andrógenos también reduce los niveles de IL-12ɑ y, en consecuencia, se reclutan menos células NK, lo que puede provocar un trastorno de citocinas. Los estudios han demostrado que una mayor administración de andrógenos promueve la producción de TGFβ, que inhibe la IL-7 y da como resultado la inhibición de la síntesis de células B.
Los andrógenos tienen un efecto inhibidor sobre las CD, provocando una reducción en la producción de citocinas producidas por ellas. Por el contrario, los andrógenos se asocian con una disminución de la producción de eosinófilos y el exceso de producción de DHT parece estar asociado con la muerte de las células T periféricas. Además, el aumento de los niveles de estrógeno provoca una secreción excesiva de citoquinas inflamatorias por parte de las células Th1. Estas conclusiones nuevamente enfatizan la compleja relación entre los andrógenos, las células inmunes y la producción de adipocitocinas en el síndrome de ovario poliquístico.
Por tanto, los andrógenos ejercen efectos dañinos sobre los adipocitos. En las mujeres con síndrome de ovario poliquístico, los adipocitos producen andrógenos, y los andrógenos regulan la diferenciación, proliferación, adipogénesis, hipertrofia de los adipocitos y, lo más importante, los andrógenos estimulan la secreción de células esteroidogénicas y adipocitos.
Las mujeres con síndrome de ovario poliquístico secretan mayores niveles de leptina y resistina y menores cantidades de adiponectina. Además, las irregularidades en la esteroidogénesis pueden provocar un deterioro de la actividad de las células inmunitarias y una secreción disfuncional de adipocitocinas. Estas funciones reguladoras de los andrógenos sobre los adipocitos y las adipocitocinas pueden empeorar los síntomas y efectos del síndrome de ovario poliquístico.
Hiperandrogenismo, resistencia a la insulina y obesidad en el síndrome de ovario poliquístico
Hiperandrogenismo en el síndrome de ovario poliquístico. El síndrome de ovario poliquístico en las mujeres se caracteriza por hiperandrogenismo (HR). La FC se define como un aumento en los niveles de andrógenos en las mujeres causado por irregularidades en las funciones ováricas o suprarrenales. Las manifestaciones clínicas de la HR en el SOP pueden incluir acné, hirsutismo, alopecia, aumento de peso, amenorrea y resistencia a la insulina. Como se mencionó anteriormente, este síntoma asociado con el síndrome de ovario poliquístico en las mujeres a menudo implica anomalías en la síntesis de esteroides. "Estudios recientes también indican que el fenotipo hiperandrogénico en el síndrome de ovario poliquístico es familiar". Esto sugiere que los genes, particularmente los involucrados en la vía de síntesis de esteroides, pueden heredarse por vía materna para causar HR y SOP. También se ha planteado la hipótesis de que la exposición fetal a un exceso de andrógenos puede provocar un aumento de la secreción de LH, cambios en la diferenciación de las células tecales y una disposición de la grasa similar a la masculina en las mujeres. Además, los estudios experimentales han destacado que la IL-1, una citocina proinflamatoria que induce la producción de andrógenos en los ovarios y anomalías en la señalización de las gonadotropinas, desempeña un papel en la alteración de la fertilidad.
Un artículo de revisión de Ashraf et al. destacó que el efecto principal del exceso de andrógenos en las mujeres son las anomalías en la foliculogénesis. En las mujeres sin síndrome de ovario poliquístico, la hormona liberadora de gonadotropina (GnRH) normalmente es secretada por el hipotálamo, lo que desencadena la liberación de gonadotropinas, LH y FSH, por la glándula pituitaria. La LH actúa sobre las células de la teca de los ovarios para producir andrógenos. La FSH actúa sobre las células de la granulosa de los ovarios para convertir los andrógenos en estrógenos y, más significativamente, el estradiol para desarrollar folículos. En las mujeres con SOP, existe "un desequilibrio en el eje hipotalámico-pituitario-ovárico", lo que resulta en una mayor producción de gonadotropinas, en particular un aumento de LH sobre FSH, lo que aumenta la "relación LH/FSH en el SOP". Un aumento de la LH impulsa una alta producción de andrógenos por las células de la teca, y una disminución de la FSH da como resultado la acumulación de andrógenos y, por tanto, la FC, debido a una menor conversión de andrógenos en estrógenos.
Debido a este cambio neuroendocrino en mujeres con SOP, varios folículos se detienen en las "etapas preantral y antral" de la foliculogénesis. Esto conduce a una hiperplasia de las células de la teca y un aumento del líquido folicular, que forma estructuras similares a quistes a lo largo de la periferia de los ovarios. Por lo tanto, una mayor producción de LH impulsa una mayor producción de andrógenos en la FC.
En cuanto a la IL-1, que inhibe la acción de los estrógenos, la citoquina contrarresta el desarrollo regular de los folículos y la reparación de la pared del endometrio después de la menstruación, lo que puede provocar infertilidad. Anteriormente se discutió que la producción de IL-1β aumenta a través de la HR causada por el exceso de DHT, lo que resulta en una mayor producción de andrógenos y la inhibición de gonadotropinas; esto refuerza aún más la infertilidad en las mujeres con síndrome de ovario poliquístico. La HR también puede aumentar la síntesis de IL-1α, lo que también puede causar mayores problemas de fertilidad en el síndrome de ovario poliquístico.
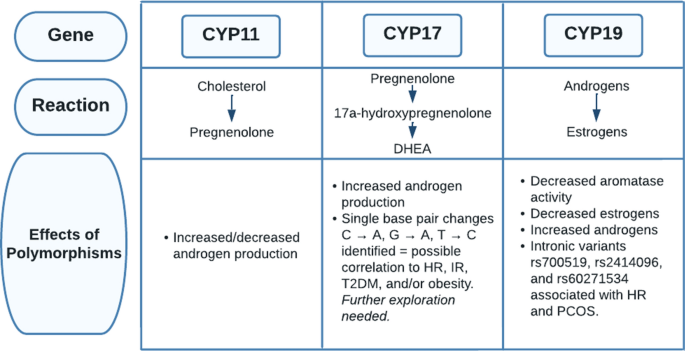
El mismo artículo también estudió la relación entre los genes implicados en la vía de síntesis de esteroides y la frecuencia cardíaca en mujeres con síndrome de ovario poliquístico. El primer paso en la esteroidogénesis, la conversión de colesterol en pregnenolona, es catalizada por la enzima de escisión de la cadena lateral del citocromo, que está codificada por el gen CYP11 (Fig. 9). Varios estudios sugirieron que los polimorfismos en el gen CYP11 pueden dar lugar a una regulación positiva o negativa de CYP11, lo que lleva a un aumento o disminución de la producción de andrógenos. A continuación, el gen CYP17 codifica la enzima citocromo P450 17ɑ-hidroxilasa-17, 20-liasa, que convierte la pregnenolona en 17ɑ-hidroxipregnenolona y la 17ɑ-hidroxipregnenolona en DHEA.
Varios estudios han destacado que la desregulación del gen CYP17 se asocia con una mayor producción de andrógenos en el síndrome de ovario poliquístico. Crocitto et al. describió un cambio de un solo par de bases de C a A en el gen CYP17 en el nucleótido 5471 en el intrón. Miyoshi et al. identificó una transición de G a A en el gen CYP17 en el nucleótido 1951 en la región promotora. Carey et al. observaron el cambio de par de bases único más significativo, donde hubo una transición de T a C en la región 5 'no traducida. Estos tres estudios identificaron una asociación entre los polimorfismos de un solo nucleótido y el síndrome de ovario poliquístico.
Otros estudios han demostrado que algunos polimorfismos están asociados con el síndrome de ovario poliquístico mientras que otros no. Estudios realizados en India concluyeron que un polimorfismo en la región promotora -34 del gen CYP17 no tenía relación con la FC, la obesidad centralizada o la resistencia a la insulina.
Por último, el gen CYP19 codifica la enzima aromatasa P450, que convierte los andrógenos en estrógenos. La citoquina IFN-γ permite la apoptosis de las células de la granulosa y la terminación del folículo. La apoptosis de las células de la granulosa hace que el IFN-γ también inhiba la enzima aromatasa, lo que da como resultado la inhibición de la producción de estrógeno. Varios pacientes con HR presentan una actividad de aromatasa disminuida. Jakimiuk et al. demostró que hay una disminución de la expresión de aromatasa y niveles reducidos de ARNm de aromatasa P450 en los folículos del SOP, lo que resulta en una disminución de los niveles de estradiol. Estos estudios indican que la disminución de la actividad de la aromatasa puede estar asociada con niveles elevados de andrógenos, lo que lleva a un desarrollo deficiente de los folículos.
Un estudio realizado por Chen y sus colegas informó una disminución en la proporción de estrógeno a testosterona en mujeres con SOP y que existe un mayor riesgo de desarrollar SOP asociado con la "variante intrónica rs2414096" del gen CYP19. De manera similar, varios otros estudios concluyeron que rs700519, rs2414096 y rs60271534 del gen CYP19 están asociados con el SOP y la HR debido a la actividad reducida de la aromatasa.
Fig. 9 An outline of the effects of polymorphisms in CYP genes on the steroidogenesis pathway in PCOS patients. DHEA dehydroepiandrosterone, C cytosine, A adenine, G guanine, T thymine, HR hyperandrogenism, IR insulin resistance, T2DM type 2 diabetes mellitus
Por tanto, la hiperandrogenemia puede contribuir a las manifestaciones anormales de las enzimas implicadas en la esteroidogénesis y al aumento de la producción de gonadotropinas a través de la interferencia de la retroalimentación del hipotálamo y la glándula pituitaria por los andrógenos. Sin embargo, la producción de gonadotropinas también puede ser inhibida por la citocina IL-1β, provocando infertilidad. El aumento de LH conduce a una hiperplasia de las células de la teca, lo que resulta en un aumento de la esteroidogénesis y la producción de andrógenos. Los genes CYP11, CYP17 y CYP19 que codifican enzimas en la vía de síntesis de esteroides aumentan la 17-hidroxiprogesterona, la testosterona y la androstenediona, pero reducen la actividad de la aromatasa. La actividad de la aromatasa también disminuye a través de la citocina IFN-γ [44]. En general, estos genes y la citocina IFN-γ aumentan la producción de andrógenos.
Resistencia a la insulina en el síndrome de ovario poliquístico. La resistencia a la insulina (RI) y, en consecuencia, la hiperinsulinemia también son rasgos característicos del SOP. La RI en el síndrome de ovario poliquístico se manifiesta típicamente como adiposidad centralizada y obesidad. La RI en el síndrome de ovario poliquístico puede deberse a varios factores. En al menos el 50% de los casos de RI en mujeres con SOP, hay fosforilación de serina mediante fosforilación del sustrato del receptor 172-1, que inhibe la señal del receptor de insulina. Dado que la fosforilación de serina regula la actividad del citocromo p450 17ɑ-hidroxilasa, una enzima involucrada en la síntesis de andrógenos, se puede decir que un solo defecto en esta enzima puede causar tanto RI como hiperandrogenismo en el síndrome de ovario poliquístico.
Una mutación genética de MTNR1B en el síndrome de ovario poliquístico también puede retrasar la producción de insulina, lo que provoca un rápido aumento de los niveles de glucosa en sangre. La 1,25-dihidroxivitamina D desempeña un papel en la homeostasis de la glucosa, donde mejora la sensibilidad a la insulina de las células del hígado, el músculo esquelético y el tejido adiposo y mejora la función de las células beta. La IR y la DM2 se asocian con una función alterada de las células beta; por lo tanto, una cantidad insuficiente de vitamina D también puede causar RI en el síndrome de ovario poliquístico.
Además, los aumentos en la citocina proinflamatoria TNF-ɑ también inhiben la función tirosina quinasa del receptor de insulina, lo que provoca aún más RI en el síndrome de ovario poliquístico. Por último, las disminuciones del óxido nítrico (NO) y los aumentos de la endotelina1 pueden causar RI en las células de la arteria endotelial, lo que lleva a la síntesis de vasoconstrictores y a una reducción de la vasodilatación por la insulina en mujeres con síndrome de ovario poliquístico positivo. La desregulación de la citoquina TGFβ conduce a una producción excesiva de colágeno y estroma que, en consecuencia, produce hipertensión a través de la inhibición del NO y la activación del RAAS. El desarrollo de hipertensión a través de este mecanismo provoca una alteración de la vasodilatación y un aumento de la vasoconstricción, lo que conduce a alteraciones en la absorción de glucosa.
En un estudio de RI en mujeres con SOP, Ding et al. determinó que la RI en el síndrome de ovario poliquístico no está relacionada con el peso; sin embargo, puede verse agravada por la obesidad. Cuando se comparó a mujeres con SOP con mujeres reproductivamente sanas con el mismo peso, el aclaramiento de glucosa regulado por insulina se redujo entre un 35 y un 40 % en mujeres con SOP. Sin embargo, la IR hepática, que se especifica por una mayor producción de glucosa postabsortiva y una disminución de la supresión de la producción endógena de glucosa por la insulina en los hepatocitos, sólo se observa en mujeres obesas con SOP. Las mujeres con síndrome de ovario poliquístico también parecen presentar mayores cantidades iniciales de insulina, pero una menor capacidad de respuesta de la insulina a los carbohidratos.
A continuación, es importante discutir el índice de disposición. Normalmente, es cuando los cambios en la sensibilidad a la insulina resultan en cambios posteriores en la secreción de insulina para regular una tolerancia normal a la glucosa. En las mujeres con síndrome de ovario poliquístico, el índice de disposición disminuye en comparación con las mujeres reproductivamente sanas y con el mismo peso. Además, la movilización del tejido adiposo a través de la IR aumenta los niveles de ácidos grasos libres en plasma, lo que induce recíprocamente la IR al inactivar enzimas que modulan el transporte de glucosa, como el piruvato deshidrogenasa. Un estudio reciente reclutó a 45 pacientes obesos con SOP en Italia para someterse a un tratamiento con acetil-L-carnitina, L-carnitina, L-arginina y N-acetil-cisteína durante un máximo de 24 semanas. Los resultados mostraron que después de 12 y 24 semanas de administración, todos los pacientes tenían niveles plasmáticos de insulina, triglicéridos y colesterol total disminuidos, pero un aumento de lipoproteínas de alta densidad. Los pacientes con SOP hiperinsulinémico mostraron un índice de extracción de insulina hepática mejorado. Por lo tanto, estos resultados resaltan que los pacientes con SOP hiperinsulinemico tienen funciones hepáticas deterioradas y el tratamiento con acetil-L-carnitina, L-carnitina, L-arginina y N-acetil-cisteína disminuye la insulina plasmática y, por lo tanto, puede controlar la hiperinsulinemia.
El estudio realizado por Ding et al. también explicó que podría haber un "acto mutuo de IR e hiperandrogenemia en los ovarios y las glándulas suprarrenales", lo que resultaría en SOP. La insulina permite la producción de andrógenos ováricos y aumenta los niveles de testosterona libre, lo que resulta en la inhibición de la SHBG y, en consecuencia, desempeña un papel en el hiperandrogenismo. Por tanto, la hiperinsulinemia parece ser relevante en la regulación de la FC, en la que provoca una producción excesiva de andrógenos por las células de la teca y gonadotropinas, provocando una secreción elevada de LH en mujeres con SOP. Los niveles elevados de insulina también pueden causar una inhibición desregulada de la GnRH por la progesterona. In vitro, la insulina también puede causar un aumento de la esteroidogénesis suprarrenal y una mayor respuesta secretora a la acetilcolina. Por lo tanto, tanto la IR como la hiperandrogenemia en el síndrome de ovario poliquístico pueden crear un ciclo en el que se estimulan mutuamente para causar efectos nocivos.
En resumen, la RI en el síndrome de ovario poliquístico puede ser causada por la fosforilación de serina de la enzima citocromo p450 17ɑ-hidroxilasa involucrada en la síntesis de andrógenos, la inhibición del TNF-ɑ de la función tirosina quinasa del receptor de insulina, una mutación en MTNR1B, vitamina D insuficiente y una disminución. en NO y un aumento en la endotelina 1 que resulta en vasoconstricción a través del TGFβ.
En cuanto a los efectos de la RI en el SOP, existe controversia sobre si la RI está relacionada o no con la obesidad y los índices de masa corporal. Los estudios demostraron que el aclaramiento de glucosa, mediado por la insulina, disminuye en mujeres con SOP, y la RI hepática se observa sólo en mujeres obesas con SOP. Los pacientes con SOP tienen niveles elevados de insulina plasmática, triglicéridos y colesterol total, pero una menor respuesta de la insulina a los carbohidratos, un índice de disposición disminuido y funciones hepáticas deterioradas. Además, se puede decir que la IR y la hiperandrogenemia en el síndrome de ovario poliquístico actúan juntas de manera cíclica para estimularse mutuamente y provocar efectos nocivos. Como se mencionó anteriormente, la IL-22 puede desempeñar un papel terapéutico en la resolución de disfunciones metabólicas en el síndrome de ovario poliquístico al reducir los niveles de glucosa y restablecer la capacidad de respuesta normal a la insulina. También puede revertir las disfunciones del metabolismo de la glucosa mediante el oscurecimiento del tejido adiposo blanco [R].
Obesidad y diabetes mellitus tipo 2 en el síndrome de ovario poliquístico. La obesidad no es una característica fundamental del síndrome de ovario poliquístico en las mujeres; sin embargo, exacerba algunos de los síntomas, especialmente la resistencia a la insulina. La grasa intraabdominal es sensible a la lipólisis y permite la liberación de ácidos grasos libres y la síntesis de citocinas que también intervienen en la resistencia a la insulina. Las mujeres obesas con síndrome de ovario poliquístico tienden a ser más obesas abdominalmente con mayor grasa visceral.
Cuando se compara a las mujeres obesas con SOP con mujeres no obesas con SOP, hay irregularidades en el ciclo menstrual, aumento del sangrado del útero, mayor preponderancia de infertilidad, aumento del hirsutismo y acné, pero niveles reducidos de SHBG en mujeres obesas con SOP. Sin embargo, la disminución de los niveles de SHBG aumenta la biodisponibilidad de la testosterona, lo que en consecuencia aumenta la hiperandrogenemia.
Además, las mujeres obesas con SOP tienen un mayor riesgo de desarrollar diabetes. La DM2 en el síndrome de ovario poliquístico puede ser causada por resistencia a la insulina y función defectuosa de las células beta. La aparición de hiperinsulinemia y la acumulación de grasa abdominal en casos de diabetes en mujeres con SOP también puede intensificar la hiperandrogenemia. Además, parece que la anovulación crónica, que puede provocar un aumento de los niveles de andrógenos, se asocia con una menor sensibilidad a la insulina, DM2 y dislipidemia. Sin embargo, el hiperandrogenismo con ovarios poliquísticos o la ovulación con ovarios poliquísticos y ningún hiperandrogenismo en mujeres no parecen tener correlación con la resistencia a la insulina o la DM2. Los estudios epidemiológicos han demostrado que la aparición de diabetes en mujeres con síndrome de ovario poliquístico tiene un odds ratio de 2,0 . Además, la citocina IL-6 parece tener una asociación con la inflamación, la obesidad al aumentar la activación de la vía AKT y la IR a través del exceso de síntesis de IL-6 .
Un estudio realizado por Barcellos et al. utilizaron una prueba de tolerancia oral a la glucosa en 85 pacientes de alrededor de 25 años con un índice de masa corporal de 28,5 ± 6,6 kg/m2. Los investigadores clasificaron la gravedad de la tolerancia a la glucosa según los niveles de glucosa en plasma en ayunas y la glucosa en plasma a los 120 minutos después de la comida. Se concluyó que los pacientes con SOP tenían una mayor prevalencia de alteración del metabolismo de la glucosa, que aumentaba con el índice de masa corporal en ambos criterios. Este estudio demostró que la prevalencia de obesidad en pacientes con SOP desempeña un papel en la amplificación de TD2M y las anomalías en la tolerancia a la glucosa. En general, los efectos del sistema inmunológico y los andrógenos en el síndrome de ovario poliquístico están entrelazados (Fig. 10). Las citocinas, otros componentes del sistema inmunológico y los andrógenos se estimulan entre sí para exacerbar los síntomas del síndrome de ovario poliquístico, como HR, IR, obesidad y DM2.
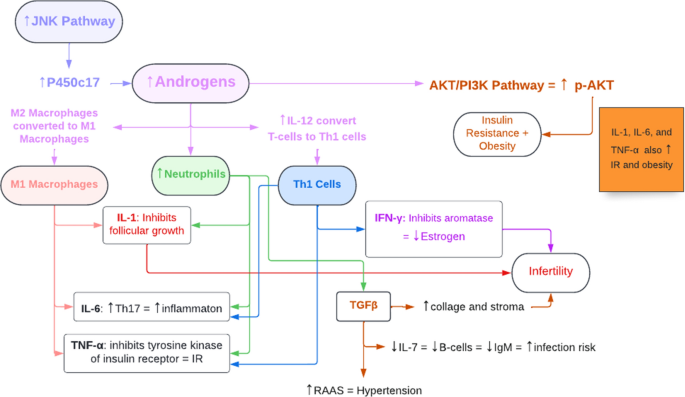
Fig. 10 The interconnections between immune cells, signaling pathways, and cytokines. RAAS renin–angiotensin–aldosterone system, p-AKT phosphorylated AKT, TNF-α tumor necrosis factor-α, IL interleukin, Th1 cells T helper 1 cells, Th17 cells T helper 17 cells, IFN-γ interferon y, TGFβ transforming growth factor β, IR insulin resistance, IgM immunoglobulin M
El papel del estrés oxidativo inducido por antioxidantes en la fisiopatología y el tratamiento del síndrome de ovario poliquístico. Se ha descubierto que las mujeres con síndrome de ovario poliquístico tienen un mayor estrés oxidativo (OS) en comparación con las mujeres sin síndrome de ovario poliquístico. Los macrófagos producen radicales libres que provocan daño celular, OS e inflamación crónica.
La OS se define como un desequilibrio en la proporción de oxidantes a antioxidantes, donde el daño causado por niveles más altos de oxidantes anula las medidas protectoras de los antioxidantes en el cuerpo. Varios factores genéticos y ambientales causan OS en el síndrome de ovario poliquístico. El mecanismo principal implica una mayor producción de especies reactivas de oxígeno (ROS), lo que provoca daño mitocondrial. Este aumento de ROS puede atribuirse a una menor cantidad de ADN-mt y mutaciones de genes mitocondriales.
Se identificó una mutación puntual única en el ARN de transferencia mitocondrial, que contribuye a la disfunción metabólica en mujeres con SOP, y un polimorfismo de un solo nucleótido en el bucle D del ADNmt. Skov et al. informaron que el transporte de electrones desde la ubiquitina al citocromo C en las mitocondrias es el componente celular más disfuncional en el músculo esquelético de las mujeres con SOP. Estas alteraciones mitocondriales pueden provocar apoptosis y disminución de la función reproductiva.
La dieta también puede estimular la OS, donde el exceso de absorción de glucosa provoca la formación de ROS y una respuesta inflamatoria. La insulina permite la síntesis de ATP a través de la fosforilación oxidativa en las mitocondrias, y las mitocondrias producen ROS para aumentar la sensibilidad a la insulina. Esto da como resultado una señalización anormal de la vía JNK y la cascada MAPK, lo que provoca una mayor fosforilación del receptor de insulina. También provoca la liberación de Nfk-B, TNF-α e IL-6, los cuales contribuyen a la resistencia a la insulina en el síndrome de ovario poliquístico.
La OS también puede causar obesidad a través de la proliferación de adipocitos y el aumento del tamaño de los adipocitos maduros. Algunos estudios indican que las ROS pueden estimular las neuronas para inducir el hambre. Además, un estudio reciente de Abudawood et al. informaron que los niveles elevados de metales pesados en el cuerpo causan OS en mujeres con síndrome de ovario poliquístico. El aumento de las concentraciones de metales pesados influye en la producción de ROS, y estos metales pesados actúan como sustancias químicas disruptoras endocrinas que pueden reducir el estado antioxidante al inducir la OS. Se encontró que las mujeres con síndrome de ovario poliquístico tenían cantidades notablemente mayores de metales pesados como arsénico, cadmio, mercurio y plomo en suero en comparación con el grupo de control. Luego se midió el estado antioxidante mediante el uso de biomarcadores antioxidantes, glutatión sérico y superóxido dismutasa sérica, los cuales disminuyeron en mujeres con SOP. Esto indica que el aumento de la concentración de metales pesados en las mujeres con SOP contribuye a una SG más alta y niveles más bajos de antioxidantes, reduciendo así la capacidad de desintoxicar las ROS del cuerpo.
El aumento de la SG causado por diversos factores genéticos y ambientales puede exacerbar los síntomas del síndrome de ovario poliquístico. Como se señaló, el aumento de la SG puede provocar resistencia a la insulina, obesidad y disminución del estado antioxidante. Los niveles elevados de ROS también pueden afectar la maduración de los ovocitos. En condiciones normales, el proceso de finalización de la meiosis I del ovocito dominante se asocia con un aumento de los niveles de ROS y la inhibición de la síntesis de antioxidantes. Luego, la meiosis II requiere protección antioxidante durante la división. El aumento de las concentraciones de ROS provoca la apoptosis de las células de la granulosa, lo que limita el desarrollo y la maduración de los ovocitos. La producción de ROS también conduce a una mayor secreción de calcio intracelular desde el retículo endoplásmico, lo que interfiere con la síntesis de ATP y, en última instancia, conduce a la necrosis celular. Esta desregulación de la liberación de calcio provoca parada folicular, lo que contribuye a anomalías menstruales y reproductivas.
La oxidación directa de las cadenas laterales de los aminoácidos conduce a la formación de productos carbonílicos que pueden alterar la función de las proteínas. Los productos de oxidación de proteínas avanzadas en plasma (AOPP) son marcadores recientemente identificados de daño celular mediado por oxidantes, que parecen elevados en mujeres con SOP. Además, la OS y la inflamación están estrechamente entrelazadas en el síndrome de ovario poliquístico. Varios estudios han encontrado que la PCR y el recuento de glóbulos blancos (WBC) aumentan en las mujeres con síndrome de ovario poliquístico. La xantina oxidasa (XO) también parece estar aumentada en el síndrome de ovario poliquístico, que es responsable de producir radicales aniónicos superóxido. Este aumento de los marcadores inflamatorios se correlaciona positivamente con la SG en mujeres con SOP. Además, las citocinas inflamatorias IL-6, IL-8 y TNF-a aumentan, mientras que la citocina antiinflamatoria IL-10 disminuye en mujeres con SOP. Por lo tanto, la OS parece ser fundamental en la patogénesis y exacerbación de los síntomas del SOP y su inflamación asociada.
OS anula la capacidad de los antioxidantes para realizar sus funciones protectoras en mujeres con SOP. Por esta razón, se han identificado varias terapias para abordar este agotamiento de antioxidantes y mejorar algunas de las complicaciones asociadas con el síndrome de ovario poliquístico.
Jamiliano et al. sugirió 50.000 UI de vitamina D durante dos semanas y 2.000 mg por día de suplementos de ácidos grasos omega-3 en mujeres con SOP durante 12 semanas. Los investigadores notaron una disminución en la testosterona sérica, la PCR, el malondialdehído (MDA) y la IL-1. Observaron una mejor salud mental, un mayor estado antioxidante y una regulación positiva del VEGF.
También se sugiere la suplementación con selenio, ya que tiene propiedades antioxidantes y puede reducir la formación de ROS. La combinación de selenio y probióticos durante 12 semanas disminuyó la MDA, la PCR, la testosterona y el glutatión, destacando sus propiedades antioxidantes y antiinflamatorias.
Otros antioxidantes que tienen la capacidad de inhibir la producción de OS y ROS incluyen el ácido alfa lipoico, la vitamina C, la vitamina E, la coenzima Q, la N-acetilcisteína, el resveratrol, la melatonina y la carnitina. El uso de estos antioxidantes en combinación con medicamentos tradicionales que inducen la ovulación puede mejorar los síntomas del síndrome de ovario poliquístico y reducir tanto la SG como la inflamación.
Algunos medicamentos pueden reducir la OS. Recientemente se ha informado que la metformina aumenta el consumo de oxígeno por parte de las mitocondrias, lo que resulta en niveles elevados de glutatión y disminución de los niveles de ROS.
Sathyapalan et al. trataron a pacientes con SOP con 20 mg de atorvastatina al día durante tres meses y observaron una disminución de la MDA. Además, Eftekhari et al. llamó la atención sobre las propiedades antioxidantes y antiinflamatorias de las especies de Mentha, indicando que varios extractos y aceites esenciales de Mentha spp. elimina radicales libres como los radicales hidroxilo, óxido nítrico, peróxido de hidrógeno y superóxido. Las propiedades degradantes de radicales libres de Mentha spp se deben a su capacidad para quelar metales y ser donadores de hidrógeno o electrones. Las propiedades antiinflamatorias provienen de la capacidad de Mentha spp. para inhibir la 5-lipoxigenasa, que luego inhibirá la producción de óxido nítrico y prostaglandina E2. La Mentha spp. también disminuye la producción de IL-1, IL-6 y COX-2.
Un estudio de Atabaadi et al. trataron ratas con síndrome de ovario poliquístico inducido con 150 mg/kg o 300 mg/kg de aceite de menta verde; las ratas tratadas con aceite de menta verde tenían una disminución del peso corporal, la testosterona y los quistes ováricos, pero presentaban un aumento de los folículos de Graaf. Esto sugiere que Mentha spp podría ser un tratamiento potencial para mujeres con síndrome de ovario poliquístico. Por último, algunas investigaciones sugieren que la terapia antioxidante es menos efectiva debido a su menor biodisponibilidad y bajos perfiles de absorción.
Las nanopartículas metálicas, comúnmente denominadas nanoantioxidantes, se han convertido en una nueva opción de tratamiento para los trastornos relacionados con el sistema operativo. Los nanoantioxidantes son materiales sintetizados artificialmente, como nanopartículas metálicas “magnéticas, de plata y oro”, que tienen una mayor biodisponibilidad, área de superficie y reactividad catalítica en comparación con los antioxidantes tradicionales y deben considerarse para el tratamiento de las complicaciones del síndrome de ovario poliquístico. Sin embargo, un efecto adverso común es la toxicidad de los nanoantioxidantes, que puede provocar una sobreproducción de ROS al inhibir la cadena de transporte de electrones en las mitocondrias. La toxicidad también puede causar una sobreexpresión de citoquinas y células inflamatorias, aumentando aún más la síntesis de ROS. Por esta razón, se deben determinar “dosis máximas efectivas” de nanoantioxidantes para prevenir efectos adversos.
En resumen, la OS es un factor fundamental en la fisiopatología del síndrome de ovario poliquístico. OS, indicativo de la naturaleza compleja del sistema inmunológico en mujeres con SOP, puede inducir inflamación. Las mujeres con SOP tienen niveles reducidos de antioxidantes que se han atribuido a la exacerbación de la resistencia a la insulina, la obesidad, el hiperandrogenismo, la disfunción reproductiva y la inflamación crónica. Esta relación oxidante-antioxidante desregulada resalta la oportunidad de nuevas opciones de tratamiento en mujeres con síndrome de ovario poliquístico. El manejo podría centrarse en reducir la producción de ROS con suplementos de antioxidantes, medicamentos como la metformina y extractos de Mentha spp. Sin embargo, es importante señalar que se necesitan más estudios clínicos sólidos que tengan el poder estadístico suficiente y utilicen intervenciones estandarizadas.
Perspectivas futuras. Estudios recientes han sugerido que el SOP podría ser un trastorno autoinmune. Por ejemplo, un estudio informó una alta presencia de anticuerpos antiováricos en el síndrome de ovario poliquístico, lo que sugiere una relación entre las células inmunes y el síndrome de ovario poliquístico (Fig. 11). Una mayor investigación sobre esta relación con el sistema inmunológico podría dar como resultado una mayor comprensión del síndrome de ovario poliquístico, así como nuevos tratamientos posibles. Sin embargo, se necesita mucha más investigación.
Fig. 11 An overview of the differences between PCOS women and non-PCOS women. T testosterone, FA fatty acids
Se han informado varios autoanticuerpos en el síndrome de ovario poliquístico, como los autoanticuerpos antinucleares (ANA), antitiroideos y antiováricos. Estos autoanticuerpos están presentes debido a los niveles bajos de progesterona en el síndrome de ovario poliquístico, lo que provoca una sobreactivación del sistema inmunológico. Esto conduce a un aumento de los niveles de estrógeno, lo que da lugar a numerosos autoanticuerpos. Se sugiere que se requieren investigaciones futuras sobre los niveles fluctuantes de autoanticuerpos en el síndrome de ovario poliquístico que posiblemente podrían conducir a tratamientos futuros para el síndrome de ovario poliquístico y que pueden ser más efectivos que los que se usan actualmente.
Un análisis informó que la mayoría de las personas con un trastorno autoinmune son mujeres, y esto puede estar relacionado con los niveles de estrógeno porque la aparición de los trastornos autoinmunes ocurre a una edad más temprana en las mujeres en comparación con los hombres. Una investigación más profunda de las razones por las que los trastornos autoinmunes son más prominentes en las mujeres podría dar una idea del síndrome de ovario poliquístico como un trastorno autoinmune.
Los fármacos sensibles a la insulina metformina y rosiglitazona disminuyeron los niveles de andrógenos en mujeres con síndrome de ovario poliquístico. Además, un estudio demostró que la administración de IL-22 en ratones reveló que la IL-22 tenía varios efectos. Estos efectos incluyeron una mejor función ovárica, una disminución de los niveles de andrógenos y una disfunción metabólica revertida. Con esta información, los investigadores podrían comparar estas sustancias para intentar determinar si una tiene mayor efecto terapéutico que la otra. La IL-22, en particular, tiene varios efectos y se podrían realizar más experimentos para posiblemente crear un tratamiento para el síndrome de ovario poliquístico o al menos abrir una nueva puerta de exploración para nuevos fármacos.
En un estudio reciente, los pacientes obesos con SOP fueron tratados con L-arginina, N-acetil-cisteína, L-carnitina y acetil-L-carnitina. Esto resultó en una disminución de los niveles plasmáticos de insulina, triglicéridos y colesterol total. Se puede concluir que el tratamiento con L-arginina, N-acetilcisteína, L-carnitina y acetil-L-carnitina puede, por tanto, controlar la hiperinsulinemia. Estudios adicionales con estas sustancias podrían conducir a planes de manejo nuevos y mejorados para la hiperinsulinemia en pacientes con SOP.
En cuanto a la OS presente en el síndrome de ovario poliquístico, la dieta es un factor contribuyente. El exceso de glucosa da como resultado la formación de ROS, lo que aumenta la sensibilidad a la insulina y provoca obesidad. Además, se ha demostrado que la vitamina D protege contra la OS al controlar la inflamación y promover la función mitocondrial. Los investigadores han probado que la vitamina D administrada a pacientes con SOP produce una disminución de la testosterona sérica, la PCR, la MDA y la IL-1.
Además, se ha demostrado que la suplementación con selenio y los probióticos disminuyen la MDA, la PCR, la testosterona y el glutatión, lo que genera propiedades antioxidantes y antiinflamatorias. Por otro lado, se ha descubierto que medicamentos potenciales reducen la SG, como la metformina, que ha demostrado disminuir los niveles de ROS. De estas pruebas se puede deducir que el control de la dieta y la suplementación contribuyen significativamente a los pacientes con SOP. A los pacientes con síndrome de ovario poliquístico se les puede proporcionar un plan de dieta que garantice el consumo regular de alimentos que contengan vitamina D y selenio y el control de su ingesta de glucosa. Investigaciones futuras podrían examinar qué tan significativo sería un cambio en la dieta en pacientes con síndrome de ovario poliquístico. Además, los pacientes con SOP podrían tomar medicamentos reductores de la SG junto con cambios en la dieta para reducir aún más los niveles de ROS.
La posibilidad de que el síndrome de ovario poliquístico sea un trastorno autoinmune aún no está bien delimitada. A pesar de que existen varias conexiones entre el síndrome de ovario poliquístico y el sistema inmunológico, hay innumerables preguntas sin respuesta y se requiere más investigación. Esta es un área vital de exploración, ya que el síndrome de ovario poliquístico es extremadamente común y una mejor comprensión de los mecanismos subyacentes y tratamientos más eficientes serían extremadamente beneficiosos.
Conclusión. La interrelación de los andrógenos y la inmunología en el síndrome de ovario poliquístico es multifacética. Precisamente por este motivo, a lo largo de los años se han desarrollado los criterios de Rotterdam para diagnosticar el SOP. El síndrome de ovario poliquístico y, en consecuencia, los recursos humanos tienen impactos desfavorables en la vida de muchas mujeres. La hipersecreción de andrógenos produce RI, obesidad, DM2, oligomenorrea, alopecia, acné, hirsutismo y otros síntomas que pueden afectar la calidad de vida. Además, la FC y varios de estos síntomas parecen actuar en un círculo vicioso en el que se estimulan mutuamente para provocar efectos nocivos. La fisiopatología del SOP y la AR aún no está clara debido a la amplia gama de manifestaciones clínicas que surgen de la compleja red de interacciones entre los andrógenos y la insulina, los adipocitos, las citocinas, las vías de señalización y las células inmunitarias. A pesar de la creciente prevalencia del síndrome de ovario poliquístico en todo el mundo, muchos aspectos de este trastorno siguen siendo ambiguos y la investigación continua tiene como objetivo comprender sus complejidades y características. Existe una oportunidad para dirigir futuros esfuerzos de investigación hacia las complejidades de la inmunología y los andrógenos en el síndrome de ovario poliquístico. Luego se podrán determinar nuevos tratamientos para el SOP basándose en la comprensión de las células inmunitarias y los niveles fluctuantes de autoanticuerpos en mujeres con SOP.


.jpeg)