El desarrollo de los órganos del tracto reproductivo de los mamíferos comienza con la formación de dos conductos genitales dentro de los mesonefros emparejados (Mullen y Behringer, 2014). El embrión, independientemente de su genotipo sexual, primero forma los conductos mesonéfricos o de Wolff, que tienen el potencial de convertirse en órganos del aparato reproductor masculino, incluidos los epidídimos, los conductos deferentes y las vesículas seminales.
Posteriormente, los conductos müllerianos o paramesonéfricos se forman a lo largo de los conductos de Wolff (Orvis y Behringer, 2007). Los conductos de Müller tienen el potencial de convertirse en órganos del aparato reproductor femenino, incluidos los oviductos, el útero, el cuello uterino y la parte superior de la vagina. La elongación de los conductos müllerianos al seno urogenital en embriones de ratones machos y hembras se completa en E13.5 (Orvis y Behringer, 2007). Durante el desarrollo sexual, un par de conductos genitales (Wolffiano o Mülleriano) se diferenciarán y el otro será eliminado. Esto está regulado por hormonas y factores de crecimiento producidos por los testículos fetales o no producidos por los ovarios fetales.
En los embriones masculinos, los testículos envían una señal a los conductos de Müller, lo que desencadena la regresión de los conductos de Müller, provocando brechas en el epitelio de los conductos de Müller que conducen a su eliminación. Esta señal viene en forma de hormona antimülleriana (AMH) (Cate et al., 1986 ; Picard et al., 1986 ; Josso et al., 1993 ; Behringer, Finegold and Cate, 1994).
El principal receptor que recibe AMH en el conducto de Müller, el receptor de la hormona anti-Mülleriana 2 (AMHR2), forma un complejo receptor con los receptores de tipo I para desencadenar la regresión (Mishina et al., 1996 , 1999 ; Gouedard et al., 2000 ; Clarke et al., 2001 , Visser et al., 2001 ;Belville et al., 2005 ; Zhan et al., 2006 ; Orvis et al., 2008). Amhr2 se expresa en el mesénquima del conducto de Müller de embriones masculinos y femeninos, lo que indica que el mesénquima es el tejido diana de la AMH y que la regresión del conducto de Müller resulta de las interacciones mesénquima-epitelial (Baarends et al., 1994). De hecho, la expresión ectópica de AMH de un transgén Mt1-AMH induce la regresión de los conductos de Müller en las hembras, lo que da como resultado la ausencia de oviductos y útero (Behringer et al., 1990). El complejo del receptor AMH emite señales a través de genes Smad redundantes (Orvis et al., 2008).
Después de esta señal inicial hay una cascada de actividad regulada genéticamente para la regresión del conducto de Müller que aún no se ha dilucidado por completo. Sin embargo, se ha descrito una red reguladora de genes basada principalmente en estudios genéticos de pérdida de función de la regresión del conducto de Müller (Moisés y Behringer, 2019).
Una adición reciente a la red reguladora de genes para la regresión del conducto de Müller es Osterix (Osx), conocida formalmente como Sp7 (Mullen et al., 2018). Osx codifica un factor de transcripción de dedo de zinc que es esencial para la diferenciación de osteoblastos y odontoblastos (Nakashima et al., 2002 ; Bae et al., 2018). Anteriormente, mostramos que Osx es un gen inducido por AMH que se expresa en el mesénquima del conducto de Müller (Mullen et al., 2018). Esto coloca a Osx aguas abajo de Amhr2 en la red reguladora de genes para la regresión del conducto mülleriano (Moisés y Behringer, 2019). A diferencia de Amhr2, que se expresa en el mesénquima del conducto de Müller de embriones masculinos y femeninos, Osx se expresa en el mesénquima del conducto de Müller solo en embriones masculinos. Curiosamente, Amhr2 y Osx están ubicados a 100 kb uno del otro.
Los potenciadores son secuencias de ADN que están unidas por proteínas para formar complejos en los promotores basales para dirigir la transcripción específica del tipo de célula y del tejido (Field y Adelman, 2020). Estas secuencias de ADN pueden residir cerca de un locus (dentro de 1 kb) o pueden ubicarse a distancias relativamente grandes (∼1 Mb) (Lettice et al., 2003). Se han identificado potenciadores 5' de un locus, dentro de los intrones, o 3' de un locus (Ornitz et al., 1985 ; Behringer et al., 1987 ; Mukhopadhyay et al., 1995). Clásicamente, los potenciadores se han identificado utilizando ensayos in vitro o in vivo .utilizando animales transgénicos. Más recientemente, el análisis de las modificaciones de la cromatina y los dominios abiertos de la cromatina han identificado potenciadores transcripcionales candidatos (Vu y Ernst, 2022). En última instancia, los potenciadores que pueden dirigir la transcripción específica de tejido deben probarse para determinar su actividad in vivo.
Aunque se han identificado elementos reguladores cis en la red reguladora de genes para la regresión del conducto de Müller para el gen Amh expresado en las células de Sertoli de los testículos, no se han identificado elementos cis para el epitelio del conducto de Müller o la transcripción del mesénquima. Anteriormente, se generaron múltiples líneas de ratones transgénicos Amhr2-EGFP utilizando una región promotora de 500 pb, pero no se detectó la expresión del indicador ( Kimura et al., 2017). Por lo tanto, la región aguas arriba inmediata de Amhr2 no es suficiente para la transcripción específica del tipo de célula.
En este estudio, buscamos identificar las regiones reguladoras asociadas con Amhr2 y Osx que dirigen la transcripción del mesénquima del conducto de Müller, utilizando un enfoque de ratón transgénico con cromosoma artificial bacteriano (BAC). Examinamos los clones de BAC que contenían Amhr2 u Osx para la actividad transcripcional específica del mesénquima del conducto de Müller en ratones transgénicos. Usando este ensayo, hemos identificado dos regiones genómicas que dirigen la actividad específica del mesénquima del conducto de Müller. La posterior identificación de las regiones reguladoras específicas de los conductos de Müller definirá aún más la red reguladora de genes para la regresión de los conductos de Müller durante la diferenciación masculina.
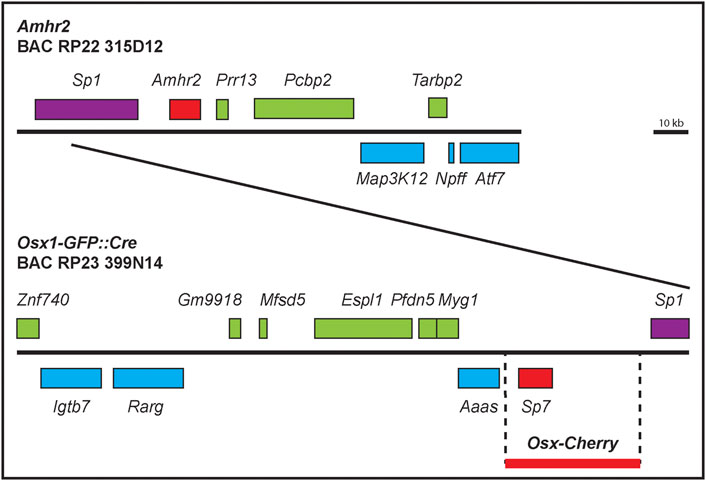
La falta de secuencias reguladoras específicas del tipo de célula en la región 5′ de 500 pb de Amhr2 (Kimura et al., 2017) nos motivó a examinar una región más grande que rodea el locus. BAC RPCI-22 315D12 tiene una región de ~147 kb (147 291 pb) del cromosoma 15 de ratón de un ratón consanguíneo 129S6/SvEvTac, que contiene el locus Amhr2 (Figura 1). Hay ~35 kb de la secuencia 5′ y ~94 kb 3′ del locus Amhr2. El clon BAC contiene otros 7 genes (Figura 1). Presumimos que las secuencias reguladoras específicas del mesénquima del conducto mülleriano Amhr2 se ubicaron dentro de este clon BAC. Para probar esta idea, generamos ratones transgénicos con este Amhr2 no manipulado.-que contiene clon BAC. Se establecieron dos líneas de ratones transgénicos independientes ( Tg BAC-Amhr2 ).
FIGURA 1 . Mapas de clones BAC que contienen Amhr2 y Osx . Diagrama de las regiones genómicas contenidas en los clones BAC RPCI-22 315D12 y RP23-399N14. Los genes (intrones y exones) están representados por recuadros encima o debajo de la línea, que representan la ubicación de los genes en las dos cadenas de ADN. También se muestra la región de ~39 kb utilizada para crear ratones Osx-Cherry (línea roja gruesa) que carece de secuencias codificantes de genes vecinos.
A continuación, cruzamos ratones macho de las dos líneas transgénicas Amhr2 BAC con ratones hembra heterocigotos para un alelo Amhr2-lacZ que también es un alelo nulo (Arango et al., 2008). El alelo Amhr2-lacZ codifica un marcador visual conveniente del útero y el oviducto porque lacZ se expresa en el miometrio y la miosálpinx, respectivamente (Arango et al., 2008). De la progenie de ese cruce, Tg BAC-Amhr2 ; Se identificaron ratones macho Amhr2 lacZ/ + y luego se cruzaron con ratones hembra homocigóticos para un alelo de deleción Amhr2 que también es un alelo nulo ( ΔE1-6 ; Mishina et al., 1996 ) para generar machos transgénicos Tg BAC-Amhr2 en un antecedente genético nulo heterocigoto compuesto Amhr2 ( ΔE1-6/lacZ ). Los machos Amhr2 ΔE1-6/lacZ sirvieron como controles para los derivados del conducto de Müller persistentes, explotando el alelo lacZ para etiquetar los derivados del conducto de Müller, es decir, el útero y los oviductos (Mishina et al., 1996 ; Arango et al., 2008).
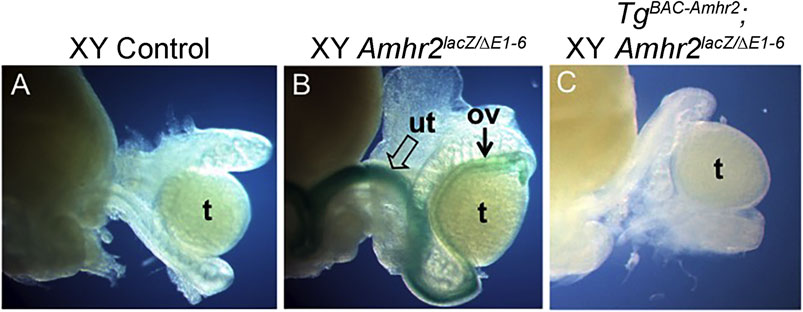
En el día postnatal 0 (P0) hubo una regresión completa del sistema mülleriano en los machos de control (Figura 2A). Se detectó tinción lacZ positiva en el útero/oviducto persistente de un Amhr2lacZ/ΔE1-6 macho (Figura 2B). Encontramos que Tg BAC-Amhr2. Los machos Amhr2 ΔE1-6/lacZ fueron negativos para la tinción con lacZ porque carecían de útero y oviducto (Figura 2C). Se observó el rescate completo delfenotipo mutante Amhr2 para ambas líneas transgénicas Amhr2 BAC (Línea 1, n = 2; Línea 2, n = 2). Esto sugiere que el clon de BAC que contiene Amhr2 de ~147 kb contiene todas las regiones reguladoras requeridas para la expresión del mesénquima del conducto de Müller para mediar la señalización de AMH para la regresión.
FIGURA 2 . Un transgén BAC que contiene Amhr2 rescata el bloqueo en la regresión del conducto de Müller de ratones macho sin Amhr2 . (A) El ratón macho de control posee solo órganos del tracto reproductivo masculino (epidídimo, conducto deferente) que se ven junto a los testículos. (B) El ratón macho Amhr2 ΔE1-6/lacZ (nulo) lleva un alelo de deleción y un alelo lacZ knock-in/knockout. La expresión lacZ marca el útero (flecha abierta) y el oviducto (flecha) que se forma en estos mutantes. (C) Ratón macho con el transgén Amhr2 BAC ( Tg BAC-Amhr2 ) en un Amhr2 ΔE1-6/lacZel fondo carece de expresión lacZ porque el bloqueo en la regresión del conducto de Müller se ha rescatado evitando la diferenciación útero/oviducto (Línea 1, n = 2; Línea 2, n = 2). Ov, oviducto; t, testículo; ut, útero.
Un transgén Osx-Cre BAC activa la expresión del reportero Cre en el mesénquima del conducto mülleriano de embriones masculinos
A continuación, utilizamos un enfoque de ratón transgénico BAC diferente para detectar regiones reguladoras específicas del mesénquima del conducto de Müller para Osx . BAC RP23-399N14 tiene una porción de ~204 kb (204 096 pb) del cromosoma 15 de ratón de un ratón hembra C57BL/6J que contiene el locus Osx (Figura 1). Hay ∼145 kb de la secuencia 5′ y ∼50 kb 3′ del locus de Osx. El clon BAC contiene otros 10 genes (Figura 1). Al igual que nuestra estrategia para identificar regiones reguladoras específicas del mesénquima del conducto de Müllerian para Amhr2 , probamos la idea de que las secuencias reguladoras específicas del mesénquima del conducto de Müllerian Osx estaban ubicadas dentro del clon BAC RP23-399N14.
Ratones transgénicos portadores de este Osx-que contienen BAC se han generado previamente (Rodda y Mcmahon, 2006). El BAC que contiene Osx se modificó previamente mediante recombinación para insertar una proteína de fusión GFP:Cre regulable por Tet-off bajo el control del promotor Osx (Osx-Cre). En ausencia de doxiciclina, Cre expresada desde el locus Osx media la recombinación de alelos floxed en ratones. Se encontró que el transgén Osx-Cre BAC es activo en el linaje de osteoblastos a lo largo del desarrollo embrionario y posnatal temprano (Rodda y Mcmahon, 2006).
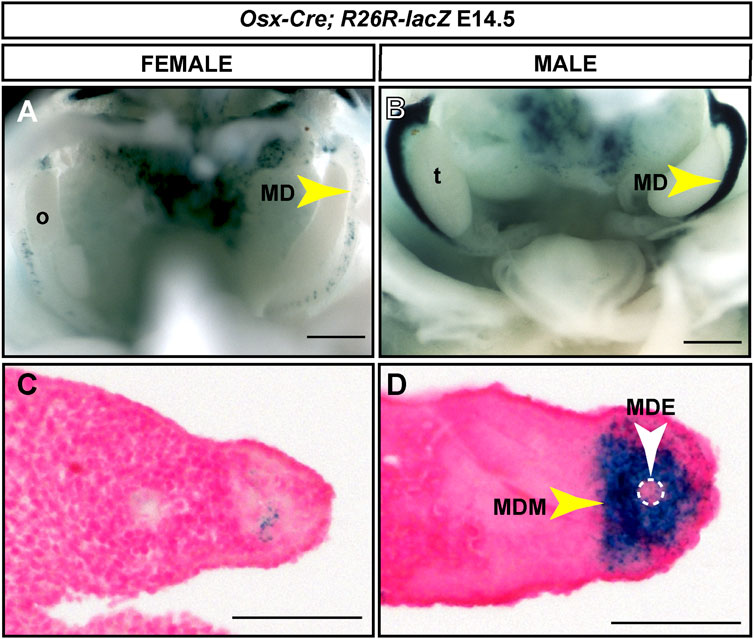
Usamos el ratón reportero R26R-lacZ Cre (Soriano 1999) para detectar la expresión de Osx-Cre en los conductos müllerianos en desarrollo. Se establecieron apareamientos cronometrados y se diseccionaron y tiñeron con X-gal los embriones E13.5 a 16.5. La tinción con X-gal se detectó inicialmente en E14.5 en los conductos de Müller en desarrollo de embriones masculinos (n = 6) (Figura 3). Aunque Osx se expresa en todo el mesénquima del conducto mülleriano masculino (Mullen et al., 2018), observamos una fuerte expresión de lacZ en el conducto mülleriano anterior, pero una expresión reducida de lacZ en el conducto mülleriano posterior (Figura 3B). También se observó tinción con X-gal en E15.5 en el conducto mülleriano masculino, en la región adyacente a los testículos (n = 4) (datos no mostrados). Se observó una población muy pequeña de células que expresan lacZ en los conductos müllerianos de embriones femeninos (Figuras 3A,C). Las secciones histológicas demostraron que la tinción con X-gal en embriones masculinos estaba restringida al mesénquima del conducto de Müller (Figura 3D). Esto sugiere que el BAC que contiene Osx de ~204 kb contiene información reguladora para la expresión del mesénquima del conducto de Müller específico masculino.
FIGURA 3 . Expresión del mesénquima del conducto de Müller específico masculino inducida por un transgén Osx-Cre . E14.5 órganos del tracto reproductivo de Osx-Cre tg/0 ; Embriones de ratón R26R-lacZ /+ teñidos para la expresión de lacZ . (A y B) Imágenes de montaje completo para embriones femeninos (A) y masculinos (B) . Barra de escala = 500um. (C y D) Secciones transversales a través de los conductos müllerianos contrateñidos con Nuclear Fast Red. Barra de escala = 50 um. t, testículo; oh, ovario; MD: conducto de Müller; MDE: epitelio de los conductos de Müller; MDM, mesénquima del conducto de Müller. Osx-Cre tg/0 ; R26R-lacZ /+ embriones masculinos, n = 6.
Una región de 39 kb que rodea a Osx dirige la expresión del reportero fluorescente de cereza del mesénquima del conducto mülleriano específico masculino en ratones transgénicos
Se generaron previamente ratones transgénicos usando ~39 kb de secuencia genómica que contenía el gen Osx derivado del clon BAC RP24-362M3 (C57BL/6J) (Strecker et al., 2013). Esta región de ~39 kb excluyó otras secuencias de codificación de genes y abarcó ~20% del BAC clonado usado para generar ratones transgénicos Osx-Cre . Se insertó un indicador de proteína fluorescente de cereza justo aguas arriba del segundo sitio de inicio de la traducción de Osx . Se detectó fluorescencia de cereza en tejidos esqueléticos en desarrollo y adultos (Strecker et al., 2013). Para determinar si la región de ∼39 kb también contenía secuencias reguladoras del mesénquima del conducto de Müller, examinamos embriones masculinos y femeninos E14.5 en busca de fluorescencia de cereza en los conductos de Müller (Figura 4).
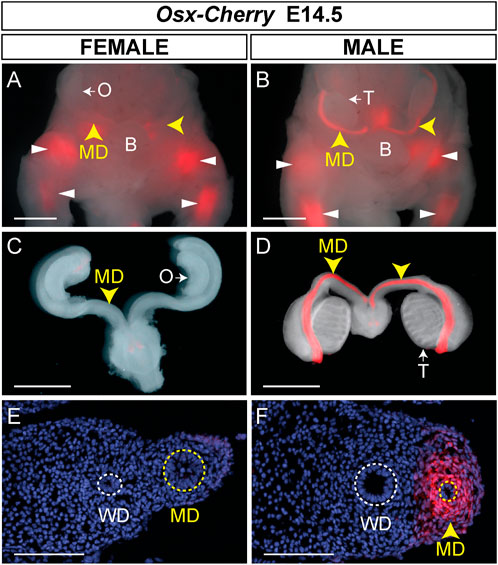
En E14.5, inicialmente identificamos embriones transgénicos Osx-Cherry porque expresan fluorescencia Cherry en el esqueleto en desarrollo. Se identificaron embriones transgénicos Osx-Cherry masculinos y femeninos mediante evaluación de campo claro de las gónadas. Aunque se observó fluorescencia Cherry en los tejidos esqueléticos en desarrollo de embriones transgénicos Osx-Cherry femeninos , no se detectó fluorescencia Cherry en los conductos müllerianos (n = 4) (Figuras 4A,C). Asimismo, se detectó fluorescencia Cherry en los tejidos esqueléticos en desarrollo de embriones transgénicos Osx-Cherry masculinos (Figura 4B). Además, se detectó fluorescencia de cereza en los conductos müllerianos (n = 6) (Figuras 4B,D). Las secciones histológicas demostraron que la fluorescencia Cherry estaba presente en el mesénquima del conducto de Müller masculino pero no en el femenino (Figuras 4E, F). También examinamos los órganos sensibles a la AMH, incluidos los testículos, los ovarios y los úteros de ratones adultos transgénicos y de control Osx-Cherry , pero no se detectó fluorescencia de Cherry en comparación con los controles (Figura complementaria S1). Estos resultados sugieren que la región genómica de ∼39 kb incluida en el transgén Osx-Cherry contiene secuencias reguladoras del mesénquima del conducto de Müller, específicas para hombres, que dirigen la transcripción de Osx .
FIGURA 4 . Expresión del mesénquima del conducto mülleriano específico masculino en ratones transgénicos Osx-Cherry . (A–D) Órganos del tracto reproductivo E14.5 de embriones de ratón Osx-Cherry tg/0 visualizados para fluorescencia Cherry. (A y B) Vistas ventrales de imágenes fluorescentes y de campo claro de montaje completo fusionadas para embriones femeninos (A) y masculinos (B) . Puntas de flecha amarillas, conductos müllerianos (MD); puntas de flecha blancas, tejidos esqueléticos. Oh, ovario; T, testículo. (C y D) Imágenes fluorescentes y de campo claro fusionadas de tractos reproductivos aislados en E14.5. (C) Mujer, (D) hombre. (E y F)Secciones transversales a través de los conductos müllerianos, visualizadas con fluorescencia Cherry y contrateñidas con DAPI. (E) Mujer, (F) hombre. WD, conductos de Wolffian. Barras de escala (A–D) = 1000 um; (E y F) = 100 um. Embriones femeninos Osx-Cherry tg/0 , n = 4; embriones masculinos, n = 6.
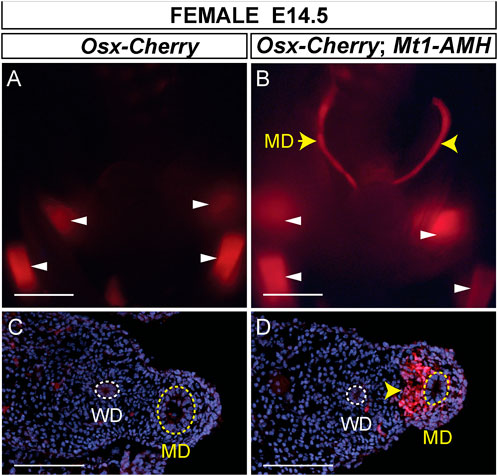
Previamente, mostramos que un alelo knock-in de Osx-lacZ se expresaba en el mesénquima del conducto mülleriano masculino pero no en el femenino, lo que refleja el patrón específico de sexo de la expresión de Osx en los conductos müllerianos (Mullen et al., 2018). También demostramos que la expresión ectópica de AMH humana a partir de un transgén Mt1-AMH podría activar el alelo knock-in Osx-lacZ en embriones femeninos, lo que indica que Osx es un gen inducido por AMH (Mullen et al., 2018). Para determinar si el transgén Osx-Cherry también podría responder a la AMH humana ectópica en embriones femeninos, cruzamos hembras Osx-Cherry con Mt1-AMH.machos para generar E14.5 Mt1-AMH; Embriones femeninos transgénicos dobles Osx-Cherry (Figura 5). Observamos fluorescencia Cherry en los conductos müllerianos de la Mt1-AMH. Embriones femeninos transgénicos dobles Osx-Cherry pero no en embriones femeninos transgénicos Osx-Cherry (n = 5) (Figuras 5A, B). La fluorescencia Cherry en los conductos müllerianos de la Mt1-AMH. Se localizaron embriones femeninos transgénicos dobles Osx-Cherry en el mesénquima (Figura 5D). Estos resultados demuestran que el Osx de 39 kbLa región contiene secuencias reguladoras del mesénquima del conducto de Müller que responden a la señalización de AMH.
FIGURA 5 . Mt1-AMH induce Osx-Cherry en los conductos müllerianos de embriones femeninos. (A y B) Imágenes de montaje completo de órganos del tracto reproductivo E14.5 de embriones de ratón hembra visualizados para fluorescencia Cherry. (A) Osx-Cherry tg/0 (B) Osx-Cherry tg/0 ; Mt1-AMH tg/0 embriones femeninos. Las puntas de flecha blancas apuntan a tejidos formadores de hueso que expresan cereza. Las puntas de flecha amarillas apuntan a la expresión de Cherry en los conductos müllerianos. (C y D) Secciones transversales a través de los conductos de Müller, visualizados para fluorescencia de cereza y contrastados con DAPI. (C) Osx-Cherry tg/0 (D) Osx-Cherry tg/0 ;Mt1-AMH tg/0 embriones femeninos. La punta de flecha en D apunta al mesénquima del conducto mülleriano que expresa Cherry. MD: conducto de Müller (línea de puntos amarilla); WD, conducto de Wolffian (línea de puntos blanca). Barras de escala (A y B) = 1000 um; (C y D) = 100 um. Cereza tg/0 ; Mt1-AMH tg/0 embriones femeninos, n = 5.
La AMH es secretada por las células de Sertoli de los testículos fetales y posteriormente interactúa con AMHR2 expresado por el mesénquima del conducto mülleriano para inducir la eliminación del epitelio ductal, bloqueando la formación de los órganos reproductores femeninos en los machos (Mullen y Behringer, 2014). Anteriormente, describimos una red reguladora de genes (GRN) para la regresión del conducto mülleriano inducida por AMH basada principalmente en datos genéticos in vivo (Moisés y Behringer, 2019). Se han identificado múltiples elementos reguladores cis en la región 5' del gen Amh con sitios de unión para SOX9, NR5A1 y GATA4 que son necesarios para la transcripción específica de los testículos ( Shen et al., 1994; De Santa Barbara et al., 1998); Arango et al., 1999; Lasala et al., 2004 ; Bouchard, et al., 2019 ). Amhr2 y Osx se expresan en el mesénquima del conducto de Müller para la regresión del conducto de Müller durante la diferenciación masculina ( Baarends et al., 1994 ; Mishina et al., 1996 ; Mullen et al., 2018 ).
Aunque se han identificado elementos reguladores cis para la expresión de Amh específica de células de Sertoli fetal , no se han identificado potenciadores de la transcripción en el resto de este GRN, especialmente para genes expresados en el epitelio o mesénquima del conducto de Müller. En este estudio, utilizamos enfoques de ratones transgénicos BAC para identificar regiones genómicas que contienen Amhr2y secuencias Osx que dirigen la expresión del mesénquima del conducto mülleriano.
Descubrimos que los ratones transgénicos generados con un clon BAC de ratón que contenía el locus Amhr2 completo rescataron los tejidos persistentes derivados del conducto de Müller que se encuentran en machos sin Amhr2 (Mishina et al., 1996 ; Arango et al., 2008). Esto sugiere que el clon BAC contiene secuencias reguladoras suficientes para la expresión del mesénquima del conducto de Müller. También es posible que la expresión de Amhr2 del clon BAC se expresara de manera ubicua. Sin embargo, esto podría conducir a la participación de los receptores de tipo I para la señalización de AMH en tejidos ectópicos que podrían conducir a fenotipos mutantes. Los ratones transgénicos Amhr2 BAC en ambas líneas eran normales y fértiles.
También probamos la región 5 'de Amhr2 de 6,2 kb, incluido el promotor endógeno para la actividad específica de tejido utilizando un reportero lacZ. Sin embargo, en 9 líneas independientes de ratones transgénicos no hubo expresión de lacZ en los conductos müllerianos E14.5 de ambos sexos, testículos adultos, ovario y útero (observaciones no publicadas). Por lo tanto, la región aguas arriba inmediata de Amhr2 no es suficiente para la transcripción específica del tipo de célula (Kimura et al., 2017). Si bien nuestros resultados actuales son un paso adelante, el clon BAC tiene una longitud de ~147 kb, lo que crea un desafío para localizar la secuencia reguladora del mesénquima del conducto de Müller en una ubicación discreta.
La transcripción de Amhr2 en el mesénquima del conducto de Müller es inducida por WNT7a secretado por el epitelio del conducto de Müller (Parr y McMahon, 1998). Los machos Wnt7a-null no expresan Amhr2 en el mesénquima del conducto de Müller, lo que conduce a un bloqueo en regresión, lo que da como resultado la formación de un útero ( Parr y McMahon, 1998 ). Por lo tanto, la señalización de WNT se encuentra aguas arriba de la transcripción de Amhr2 en GRN (Moisés y Behringer, 2019). Además, se requiere beta-catenina en el mesénquima ductal para la regresión del conducto mülleriano durante la diferenciación masculina (Kobayashi et al., 2011). Estas observaciones sugieren que puede haber elementos cis relacionados con la señalización de WNT que se requieren para la transcripción de Amhr2 .
Amhr2 también se expresa en Sertoli, células de la granulosa y músculo liso del miometrio uterino (Arango et al., 2008). Se ha demostrado que la expresión de Amhr2 en estos tipos de células está regulada por múltiples factores. Se demostró que se requiere un sitio de unión para NR5A1 (también conocido como SF-1) ubicado dentro de ~300 pb aguas arriba del sitio de inicio de la transcripción del gen AMHR2 humano para la expresión del reportero en la línea celular de teratocarcinoma NT2/D1 (De Santa Barbara et al. al., 1998). La eliminación de Dmrt1 en embriones de pollo macho provocó una regulación a la baja de Amhr2 (Cutting et al., 2014). Se demostró que BMP4 y BMP15 mejoran AMHR2 niveles de transcripción en células de la granulosa de ovario humano y de oveja in vitro (Pierre et al., 2016). Esta respuesta a la señalización de BMP estuvo mediada por una región 5 'de ~2.2 kb del promotor AMHR2 (Pierre et al., 2016). Se identificó un ARN largo no codificante (lnc), lnc-Amhr2, que mejoró la actividad del promotor de Amhr2 en una línea celular de granulosa de ovario de ratón, OV3121 (Kimura et al., 2017). Quedan por descubrir los factores que regulan la transcripción de Amhr2 en las células del mesénquima del conducto de Müller.
El BAC utilizado para generar la línea Osx-Cre abarca 204 kb del cromosoma 15, desde el extremo 3′ de Znf40 hasta el extremo 5′ de Sp1 . Utilizando la línea de ratones transgénicos Osx-Cre BAC, descubrimos la expresión del gen informador Cre específico de macho en el mesénquima del conducto mülleriano. Aunque el gen Osx endógeno se expresa en todo el mesénquima del conducto mülleriano masculino (Mullen et al., 2018), encontramos que la expresión del gen reportero dirigido Osx-Cre predomina en el conducto mülleriano anterior. Es posible que haya elementos cis separados que dirijan la expresión anterior y posterior. Sin embargo, estos hallazgos pueden ser exclusivos de esta línea de ratones transgénicos.
El constructo Osx-Cherry abarca 39 kb dentro de la región BAC Osx-Cre de 204 kb, que abarca Osx y secuencias intergénicas en los extremos 5' y 3' del gen. Usando la línea de ratones transgénicos Osx-Cherry , encontramos fluorescencia Cherry específica de macho a lo largo de toda la longitud de los conductos de Müller, lo que indica que la región de 39 kb contiene secuencias reguladoras específicas del mesénquima del conducto de Müller. La señalización de AMH es necesaria y suficiente para la expresión de Osx en el mesénquima del conducto de Müller (Mullen et al., 2018). Descubrimos que la AMH ectópica proporcionada por un transgén Mt1-AMH podría inducir Osx-Cherryexpresión en el mesénquima del conducto mülleriano de embriones femeninos. Esto sugiere que la región Osx de 39 kb contiene secuencias que responden a la señalización de AMH. Las secuencias que dirigen la transcripción específica del mesénquima del conducto de Müller y las que median la señalización de AMH pueden ser las mismas, pero esperan más estudios.
En el genoma del ratón, Osx y Amhr2 están vinculados y residen en el cromosoma 15 con una diferencia de 100 kb entre sí. Hay un gen, a saber, Sp1, ubicado entre Osx y Amhr2 . Sp1 codifica un factor de transcripción que se expresa en la mayoría de los tejidos (O'connor et al., 2016). Curiosamente, la región Osx-Cherry de 39 kb (NCBI37/mm9: Chr 15, 102,182,823–102,220,102) no se superpone con el clon Amhr2 BAC (NCBI37/mm9: Chr 15, 102,401,136–102,548,427). Por lo tanto, la región reguladora del mesénquima del conducto de Müller que identificamos para Osx-Cherry es distinta de la identificada dentro delamhr2 bac. La identificación de dos regiones reguladoras distintas del mesénquima del conducto mülleriano, una para Amhr2 y otra para Osx , parece razonable porque Amhr2 se expresa en el mesénquima de los conductos müllerianos masculinos y femeninos que depende de WNT7A derivado del epitelio, mientras que la expresión de Osx está restringida a conductos müllerianos masculinos que depende de Amhr2 y AMH secretada por los testículos fetales ( Baarends et al., 1994; Parr y McMahon, 1998 ; Arango et al., 2008 ; Mullen et al., 2018).
Por lo tanto, Amhr2 está aguas arriba de Osxen el GRN. El análisis del paisaje de la cromatina del mesénquima del conducto de Müller masculino y femenino E14.5 podría apuntar a elementos reguladores específicos del conducto de Müller. Sin embargo, este tipo de estudios no se han informado quizás porque hay muy pocas células por embrión y los enfoques de células individuales aún requieren un número de células mayor que el disponible en la práctica. La identificación de regiones genómicas que contienen secuencias reguladoras para la expresión del mesénquima del conducto mülleriano contribuye a la definición de este GRN del desarrollo sexual (Moisés y Behringer, 2019).

No hay comentarios:
Publicar un comentario