
A pesar de las disminuciones generales en la tasa de natalidad nacional en los Estados Unidos, la tasa de natalidad de las mujeres cisgénero de 35 a 45 años ha aumentado en las últimas 3 décadas. La elección de retrasar el embarazo es una decisión intensamente personal y se ha relacionado con la búsqueda de un avance profesional, la falta de una pareja adecuada o la falta de preparación para tener hijos.
La crioconservación de ovocitos se está convirtiendo en una opción cada vez más popular, que ofrece a las pacientes la oportunidad de retrasar el embarazo al mismo tiempo que aumenta la posibilidad de concebir en una fecha posterior.
Tradicionalmente, la criopreservación de ovocitos se ha reservado para pacientes seleccionadas con indicaciones médicas, incluidas las que se someten a terapias gonadotóxicas como la quimioterapia, las pacientes con endometriosis o predisposición genética a la disminución de la fertilidad y las que buscan la preservación de la fertilidad en el contexto de cirugía y hormonas de afirmación de género. Desde la decisión de 2013 de la Sociedad Estadounidense de Medicina Reproductiva de retirar su etiqueta experimental, ha habido un aumento del 400 % en la demanda de criopreservación de ovocitos. Además, la proporción de pacientes menores de 35 años que optan por la criopreservación ha aumentado del 25 % en 2012 al 35 % en 2022. Se espera que este aumento continúe a medida que muchas empresas comiencen a ofrecer cobertura de seguro para este procedimiento como estrategia de contratación de empleo. Aunque la literatura que investiga los resultados relacionados con los embarazos concebidos a través de la criopreservación aún no ha alcanzado este aumento en la demanda, los médicos deben estar preparados para aconsejar a las pacientes que consideren la criopreservación planificada de ovocitos.
Asesoramiento para la disminución de la fertilidad relacionada con la edad.
La disminución de la fertilidad relacionada con la edad generalmente comienza en personas de 32 años, con disminuciones más significativas en personas de 37 años o más debido a la disminución en el número de folículos y la calidad de los ovocitos secundaria a cambios relacionados con la edad. Los resultados de algunos estudios han encontrado que el nivel de fertilidad es más alto en pacientes nulíparas de 27 a 28 años y pacientes nulíparas de 29 a 30 años. Además, la edad avanzada en el momento de la concepción se asocia con mayores tasas de aneuploidía y pérdida fetal.
Aunque la criopreservación de ovocitos planificada no puede controlar todos los factores de riesgo asociados con el aumento de la edad materna, la preservación de los ovocitos puede reducir el riesgo de aneuploidía de una paciente y mejorar la probabilidad de un embarazo viable. Los embarazos concebidos espontáneamente ya través de la criopreservación de ovocitos muestran valores comparables en el peso medio al nacer y la tasa de anomalías congénitas y deficiencias en el desarrollo. Sin embargo, los proveedores deben comunicar que hay escasez de datos sobre los resultados a largo plazo en estos niños.
Al considerar a quién asesorar sobre la infertilidad, los médicos deben informar a todos los pacientes sobre la disminución de la fertilidad relacionada con la edad. Sin embargo, es especialmente importante educar a las mujeres en profesiones muy exigentes que han demostrado experimentar tasas más altas de infertilidad y son mayores en promedio en el momento del primer parto.
Tasas de éxito esperadas
Los datos de resultados con respecto a las tasas de éxito del embarazo relacionadas con la edad después de la criopreservación siguen siendo limitados, porque la mayoría de las mujeres que han congelado sus óvulos aún no han vuelto a usarlos. La Figura 1 muestra un resumen de las tasas de éxito esperadas con base en una herramienta líder de asesoramiento sobre criopreservación, pero se debe tener en cuenta que esta herramienta se basa en proyecciones de probabilidad calculadas y no en datos de resultados reales.
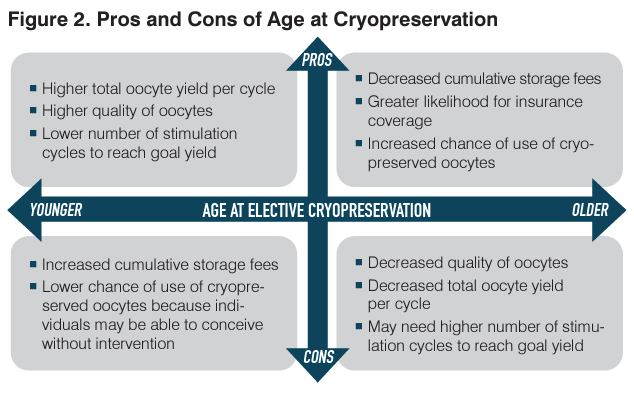
La extracción y congelación de óvulos a una edad más temprana se correlaciona con una mayor probabilidad de nacimiento vivo cuando se controla el total de ovocitos congelados. Congelar óvulos a una edad más temprana también disminuye la necesidad de múltiples ciclos de estimulación de ovocitos y reduce el riesgo de aneuploidía asociada con ovocitos más viejos. Para las mujeres que se sometieron a criopreservación a una edad avanzada (media de 38 años), los resultados de un pequeño estudio retrospectivo encontraron una tasa de nacidos vivos del 27 % por mujer.

A pesar de los beneficios de la recuperación temprana de ovocitos, los médicos deben asesorar a las pacientes sobre la necesidad de un almacenamiento más prolongado y el aumento de las tarifas resultantes y sobre la posibilidad de que las pacientes puedan concebir sin intervención, lo que lleva a que los óvulos crioconservados no se utilicen.
Costos esperados
El costo total de la crioconservación depende del grado de cobertura del seguro. Se debe advertir a las pacientes que existen múltiples costos integrados en el proceso, incluidos los medicamentos para la estimulación ovárica; monitoreo de laboratorio y ultrasonido; el procedimiento de recuperación de ovocitos; anestesia; crioconservación de ovocitos; tarifa anual de almacenamiento de ovocitos; tarifas asociadas con el calentamiento, la inyección intracitoplasmática de espermatozoides (ICSI)/FIV y el cultivo de embriones; y el futuro procedimiento de transferencia de embriones.
Criopreservación planificada de ovocitos
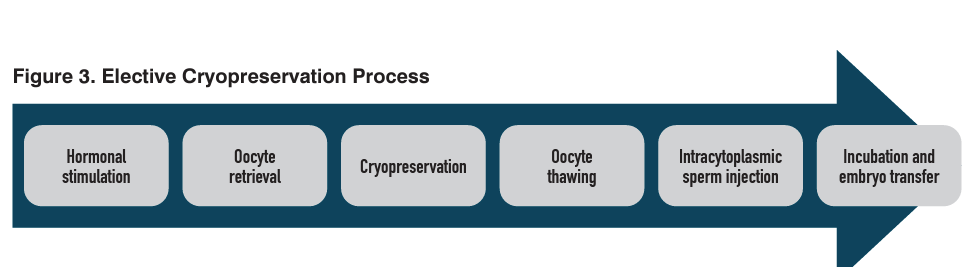
Su paciente ha decidido congelar sus óvulos. ¿Qué deben saber sobre el proceso antes de emprender este viaje? En el nivel más complicado, el proceso de congelación de óvulos incluye la estimulación hormonal de los ovarios; recuperación de ovocitos transvaginal; congelación y almacenamiento de óvulos; y descongelación de óvulos, determinación de viabilidad y uso en ICSI/FIV para lograr el embarazo ( Figura 3).
Es importante evaluar otras comorbilidades reproductivas, como el síndrome de ovario poliquístico, que pueden influir en la elección del régimen de estimulación, y determinar si la paciente se ha sometido a ciclos previos de estimulación ovárica. Las pruebas típicas previas al procedimiento pueden incluir hormona estimulante del folículo (FSH) y estradiol en los días 2 a 4 del ciclo; hormona antimulleriana; y talla, peso e índice de masa corporal. Además, la ecografía inicial de los ovarios mide el recuento de folículos antrales y garantiza el acceso a los ovarios para la recuperación planificada de ovocitos. Las pruebas de laboratorio de fertilidad, las imágenes y un historial completo de fertilidad antes de la estimulación ovárica ayudan a informar qué protocolo de estimulación es el más apropiado.
Un mensaje importante para transmitir a los pacientes sobre la criopreservación es que la intención de un protocolo de estimulación hormonal es inducir y sostener el crecimiento de múltiples folículos que conducen a múltiples ovocitos. Es importante destacar que la estimulación ovárica exógena no agota la reserva ovárica; más bien, se mantienen más ovocitos en lugar de sufrir atresia natural. Durante un ciclo normal (sin crioconservación), el cuerpo desarrolla de manera similar múltiples folículos. Sin embargo, solo 1 ovocito se desarrolla por completo y el resto de los folículos expira.
Estimulación ovárica controlada
Un solo ciclo de estimulación ovárica suele durar aproximadamente 10 días, con una meta de 10 a 20 ovocitos por ciclo. Los rendimientos más altos se asocian con una edad más joven, pero las personas de 35 años o más pueden seguir múltiples ciclos de estimulación para compensar la menor calidad y cantidad de ovocitos. Sin embargo, para pacientes de 40 años o más o con una reserva ovárica disminuida, esta estrategia puede no proporcionar una cantidad adecuada de ovocitos normales para tener éxito.
Hay muchos protocolos de estimulación con diferentes regímenes y dosis de fármacos. Los regímenes suelen contener agentes gonadotrópicos para estimular el crecimiento de los folículos, un agente que detiene la ovulación de los óvulos antes de la recuperación y un agente que induce la maduración de los óvulos. A veces, las píldoras anticonceptivas orales se usan antes de la estimulación para regular el ciclo de una paciente o suprimir la respuesta ovárica en pacientes con hiperrespuesta. Para aquellas con niveles elevados de FSH (es decir, reserva ovárica disminuida), se puede usar el cebado de estrógeno previo a la estimulación para normalizar la producción de gonadotropina a través de un ciclo de retroalimentación negativa. La figura 4 muestra un resumen de los medicamentos que se utilizan con frecuencia en la estimulación ovárica.

Aunque las dosis de gonadotropina pueden variar entre pacientes y protocolos, se debe usar una cantidad suficiente para garantizar una recolección de óvulos adecuada. Sin embargo, las dosis de gonadotropina que son demasiado altas también se asocian con un mayor riesgo de síndrome de hiperestimulación ovárica (SHEO) y un mayor costo.
Se ha demostrado que los protocolos de agonista y antagonista prolongados tienen una eficacia similar cuando se mide por las tasas de nacidos vivos/ciclo. Con cada ciclo, se estimula una nueva cohorte de folículos. Esto significa que incluso si un protocolo anterior dio como resultado un bajo rendimiento, el mismo régimen de medicamentos aún puede tener éxito en ciclos futuros. Durante la estimulación, las pacientes reciben análisis de sangre frecuentes para controlar los niveles hormonales y ecografías transvaginales para evaluar el recuento y el crecimiento de los folículos. También se autoinyectan medicamentos de estimulación por vía subcutánea todos los días.
Efectos adversos de medicamentos
Una de las principales preocupaciones durante el proceso de estimulación es el SHO, una complicación causada por una respuesta ovárica exagerada a los medicamentos de estimulación. Se ha relacionado con el uso de gonadotropina coriónica humana en protocolos de estimulación.
Los síntomas incluyen dolor abdominal, náuseas/vómitos, ascitis, peritonitis localizada o generalizada, disnea, hipotensión/hipovolemia, hipercoagulabilidad, desequilibrio electrolítico e insuficiencia renal aguda. El riesgo de SHO moderado (evidencia ultrasonográfica de ascitis) es del 3% al 6%, mientras que el SHO grave (clasificación moderada más dolor abdominal intenso y/o derrame pleural) ocurre en el 0,1% al 2% de todos los ciclos. El SHO suele ser autolimitado, pero los casos graves pueden requerir hospitalización, paracentesis y/o anticoagulación. Los efectos adversos adicionales asociados con los medicamentos gonadotrópicos (p. ej., Gonal-F, Follistim, Ovidrel, Menopur y Luveris) incluyen fatiga, dolores de cabeza, aumento de peso.
Recuperación de ovocitos
Independientemente del protocolo de estimulación, los ovocitos maduros se recuperan de 34 a 36 horas después de la administración de la inyección de activación, generalmente un agonista de la gonadotropina coriónica humana o de la hormona liberadora de gonadotropina (GnRH), que induce la reanudación de la meiosis del ovocito. La extracción de ovocitos se realiza con una aguja larga bajo ultrasonido transvaginal. La aguja se guía transvaginalmente hacia cada folículo, aspirando ovocitos, células de la granulosa y líquido folicular. La sedación intravenosa se utiliza para minimizar las molestias. Los riesgos asociados con la recuperación, aunque pequeños, son 20 :infección debida a la transferencia de bacterias vaginales a la cavidad abdominal mediante aguja (0,01 %-0,6 %), traumatismo en órganos intraabdominales con uso de agujas (raro, descrito como informes de casos), y sangrado intraabdominal cuando la aguja del procedimiento atraviesa una pared vaginal vascularizada para obtener ovocitos (0,02%-0,3%).
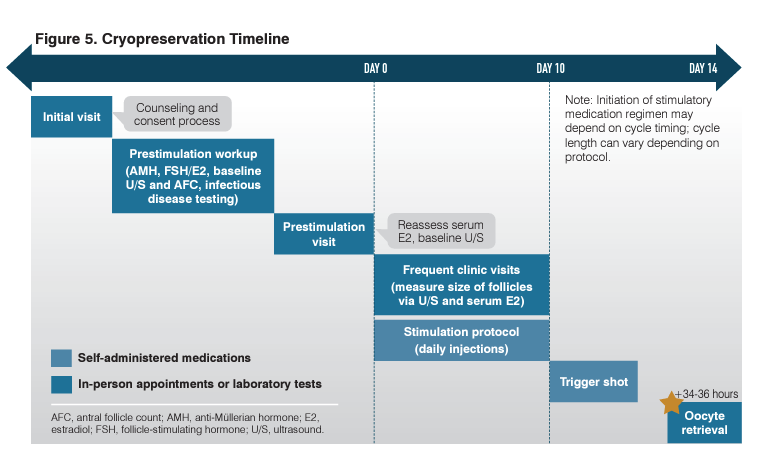
Los proveedores deben aconsejar a las pacientes sobre el riesgo de que el procedimiento no logre obtener óvulos o que los óvulos sean anormales o de mala calidad, lo que impide un embarazo viable. Los pacientes pueden experimentar calambres abdominales inmediatamente después de la extracción y un período menstrual más intenso, acompañado de síntomas más intensos del tipo del síndrome premenstrual, de 10 a 14 días después del procedimiento, que es el resultado de la estimulación hormonal que conduce al engrosamiento del revestimiento uterino. La Figura 5 proporciona una línea de tiempo que demuestra los principales hitos en el proceso de crioconservación.
Los óvulos maduros cosechados se congelan con un método de congelación instantánea conocido como vitrificación, que ahora es el método preferido de criopreservación. Las células del cúmulo (es decir, las células de sostén) se extraen de los huevos y la cubierta externa conocida como zona pelúcida se endurece con la congelación. Por estas razones, se recomienda la ICSI directamente en el óvulo para la fertilización. Al comparar el uso de ovocitos frescos con el uso de ovocitos congelados que sobreviven a la descongelación, se ha demostrado que las tasas de embarazo clínico son equivalentes.
Descongelación y fertilización
Cuando las pacientes están listas para intentar el embarazo, los óvulos criopreservados se descongelan. Las tasas estimadas de supervivencia de los óvulos después de la descongelación son del 95 % para mujeres de 35 años o menos y del 85 % para mujeres de 36 años o más. Se inyecta un solo espermatozoide directamente en el óvulo usando una aguja de vidrio delgada a través de ICSI. Los embriones se incuban y finalmente se transfieren al útero en los días 3 a 5 de desarrollo para lograr el embarazo. Para los pacientes que desean pruebas genéticas, los embriones se pueden biopsiar y congelar en el día 5 o 6. Los embriones genéticamente normales (euploides) se pueden descongelar más tarde y transferir al útero.
Los pacientes también pueden considerar la crioconservación de embriones, especialmente los pacientes con parejas establecidas o aquellos que planean usar esperma de donante. Sin embargo, existen implicaciones legales importantes (que varían según el estado) que se deben considerar al usar el esperma de una pareja. Debido a que los embriones contienen material genético de 2 individuos, existe una propiedad legal compartida y la oportunidad de que cualquiera de los dos prohíba su uso en futuros embarazos.
PARA LLEVAR
- La criopreservación planificada de ovocitos, o la congelación electiva de óvulos, se está convirtiendo en un procedimiento cada vez más popular para combatir la disminución de la fertilidad relacionada con la edad a medida que más personas optan por retrasar el embarazo.
- La extracción y congelación de óvulos a una edad más temprana se correlaciona con una mayor calidad y cantidad de ovocitos por ciclo de estimulación, lo que lleva a una mayor probabilidad de nacimiento vivo cuando se controla el total de ovocitos congelados.
- La estimulación ovárica controlada con medicamentos hormonales y la recuperación de ovocitos, los mismos pasos iniciales de la fertilización in vitro (FIV), generalmente demoran aproximadamente de 10 a 14 días en completarse.
- Al comparar el uso de ovocitos frescos versus congelados, las tasas de embarazo clínico son equivalentes.
- La criopreservación puede ser extremadamente costosa y solo a veces está cubierta por el seguro médico, aunque la cobertura está aumentando.
Limitaciones
Independientemente del mecanismo de fertilización, los embarazos de mujeres mayores de 35 años tienen mayor riesgo de preeclampsia, hipertensión y diabetes gestacional y tienen una mayor probabilidad de requerir parto por cesárea. Aunque la criopreservación planificada de ovocitos permite a las pacientes aumentar la probabilidad de lograr un nacimiento vivo, es fundamental que los médicos aconsejen a las pacientes sobre los factores de riesgo persistentes asociados con los embarazos en edad materna avanzada y los riesgos del procedimiento, los costos estimados y los factores que influyen en la probabilidad de un embarazo. embarazo exitoso. Los proveedores también deben presentar alternativas a la crioconservación, como la adopción y el uso de ovocitos de donantes, al explorar métodos para formar familias en el contexto de una posible infertilidad futura relacionada con la edad.
Aunque se han logrado grandes avances en la tecnología de reproducción asistida en las últimas décadas, la criopreservación planificada de ovocitos no es una póliza de seguro infalible contra la infertilidad.

No hay comentarios:
Publicar un comentario