El sangrado perimenopáusico puede deberse a causas estructurales (pólipos, adenomiosis, leiomiomas, malignidad) o causas no estructurales (coagulopatía, disfunción ovulatoria, factores endometriales, iatrogénicos o "no clasificados de otra manera"). La malignidad y la disfunción ovulatoria en particular son más comunes en esta población.
La evaluación inicial incluye antecedentes y examen físico, ecografía y posible sonohisterografía con infusión de solución salina o biopsia endometrial.
Se pueden usar tratamientos hormonales, al igual que con las mujeres premenopáusicas, pero las comorbilidades más frecuentes y una posible necesidad de transición a la terapia de reemplazo hormonal pueden influir en la elección del tratamiento. También pueden ser útiles los análogos de GnRH orales más nuevos.
Se pueden considerar procedimientos como la polipectomía histeroscópica, la ablación endometrial y la embolización de la arteria uterina cuando las hormonas no son útiles o están contraindicadas, aunque la ablación en particular puede dificultar la evaluación posterior del endometrio.
La histerectomía sigue siendo una opción razonable para las mujeres que han fracasado con un tratamiento más conservador.
Prevalencia y causas del sangrado uterino anormal . El sangrado perimenopáusico es difícil de definir porque distinguir el sangrado uterino normal del anormal (SUA) durante un momento de la vida en el que los ciclos menstruales de una mujer cambian dinámicamente requiere un grado adicional de perspicacia clínica y atención. El Colegio Estadounidense de Obstetras y Ginecólogos (ACOG) define AUB como: "sangrado del cuerpo uterino que es anormal en su regularidad, volumen, frecuencia o duración y no está asociado con el embarazo".

La prevalencia de AUB es de 3 a 30%, con prevalencias más altas agrupadas en los extremos de la vida reproductiva: perimenarquia y perimenopausia. Las mujeres perimenopáusicas pueden experimentar irregularidades menstruales que consisten en ciclos menstruales más cortos y ciclos con o sin ovulación. Tanto los ciclos cortos (<21 días) como los largos (> 36 días) se asocian con patrones anovulatorios de secreción de progesterona. Es más probable que los ciclos anovulatorios estén asociados con manchado. Algunos ciclos menstruales acortados son el resultado del llamado LOOP, fenómeno de desfase lúteo, en el que la foliculogénesis comienza durante la fase lútea que precede a la menstruación. Los ciclos anovulatorios se han asociado con un sangrado más abundante que suele ser esporádico, pero que puede ser agudo. Por tanto, algo de SUA en la perimenopausia puede ser fisiológico. Las lesiones estructurales del útero (PALM) como pólipos, adenomiosis, leiomiomas y neoplasias malignas no son infrecuentes en las mujeres en los años perimenopáusicos.
PÓLIPOS. En una cohorte de 64 mujeres asintomáticas con una edad media de 44 años, se observó que el 16% tenía pólipos. Otra muestra de 112 mujeres en edad reproductiva con pólipos endometriales seguidos durante casi 2 años indicó que el 15% desarrolló SUA.
ADENOMIOSIS. La adenomiosis tiene una prevalencia que oscila entre el 5 y el 70%; sin embargo, el 70-80% de las mujeres que se someten a histerectomía por adenomiosis se encuentran en la cuarta a quinta década de la vida. Por lo tanto, la adenomiosis parece causar la mayoría de los síntomas alrededor de la perimenopausia. Algunos argumentan que la adenomiosis, presente en el 48% de las muestras de histerectomía, no está necesariamente asociada con hemorragia y puede ser una variante normal y no una enfermedad. Sin embargo, la SUA atribuida a la adenomiosis no suele ser susceptible de tratamiento médico y, a menudo, requiere tratamiento quirúrgico.
LEIOMIOMAS. En una muestra basada en la población de 650.000 mujeres estadounidenses de entre 18 y 65 años en el sistema de Kaiser Permanente Washington, el 15,9% de las mujeres de entre 50 y 54 años tenían leiomiomas, la prevalencia más alta de la muestra; las tasas máximas de incidencia se dieron entre los 45 y los 49 años. Estos números se alinean con la muestra de Waay, et al, en la que el 23% de las mujeres tenían leiomiomas por ecografía. La tasa de crecimiento de los leiomiomas fue más rápida en las mujeres premenopáusicas y más lenta en las mujeres que estaban más cerca de su período menstrual final.
MALIGNIDAD. La edad promedio al momento del diagnóstico del cáncer de endometrio es de 60 años y los casos son relativamente poco comunes antes de los 45 años. Clínicamente, se recomienda que las mujeres perimenopáusicas con SUA se realicen pruebas de detección con muestras de endometrio para descartar cáncer. Dado que los patrones de sangrado son intrínsecamente irregulares para las mujeres perimenopáusicas, y el sangrado uterino disfuncional debido a la anovulación puede causar episodios aislados de sangrado abundante, muchas mujeres se someten a una muestra de endometrio, pero muy pocas tendrán hiperplasia o cáncer.
EL OTRO LADO DEL COEIN . Las coagulopatías generalmente se diagnostican más temprano en la vida; sin embargo, las mujeres perimenopáusicas pueden adquirirlos. La enfermedad de Von Willebrand (EvW) está presente en el 1% de las mujeres y el 95% de las mujeres con EvW informan sangrado menstrual abundante. La disfunción plaquetaria puede estar presente en la EvW y la trombocitopenia inmune, que tiene una prevalencia general de 1 / 10,000, aumenta con la edad. Los trastornos ovulatorios, descritos anteriormente, son relativamente comunes en mujeres perimenopáusicas. Hasta el 7% de las mujeres tienen síndrome de ovario poliquístico (SOP) y son anovulatorias crónicas. Las causas del endometrio incluyen la endometritis crónica.La verdadera prevalencia de la endometritis crónica y su definición histológica no están bien establecidas, pero el diagnóstico debe sospecharse en mujeres con hemorragia intermenstrual y síntomas generales leves. Otras formas de disfunción endometrial y falla de los mecanismos hemostáticos normales que permiten que la menstruación se detenga son poco conocidas, pero parecen ser responsables de algunos casos de SUA en la perimenopausia.
La anticoagulación terapéutica y la trombocitopenia asociada a quimioterapia son posibles causas iatrogénicas de SUA, al igual que cualquier tipo de terapia hormonal exógena que pueda causar hemorragia intermenstrual. Algunos medicamentos también pueden interferir con el ciclo menstrual normal, como los antagonistas de la dopamina, y provocar sangrado anovulatorio acíclico (pero con mayor frecuencia causan oligomenorrea).
Finalmente, una categoría de trastornos 'No clasificados de otra manera' es responsable del resto de los casos. Estas últimas afecciones son raras, pero pueden incluir sangrado de divertículos uterinos relacionados con la cicatriz de la cesárea, que acumulan sangre y esporádicamente causan manchas.
La discusión de la historia de la paciente debe incluir una revisión del patrón de hemorragia de la paciente, uso de anticonceptivos, factores de riesgo de cáncer de endometrio, problemas médicos, antecedentes personales o familiares de trastornos hemorrágicos subyacentes y medicamentos actuales.
El examen físico debe incluir exámenes con espéculo y bimanuales y examen de tiroides. Las pruebas de laboratorio pueden incluir un hemograma completo, pruebas de embarazo, estudios de coagulación, evaluación de trastornos hemorrágicos como la EvW y exámenes de tiroides. Los pacientes con hemorragia aguda que son hemodinámicamente inestables requieren manejo quirúrgico o tratamiento con estrógenos en dosis altas y no se discutirán más en esta revisión.
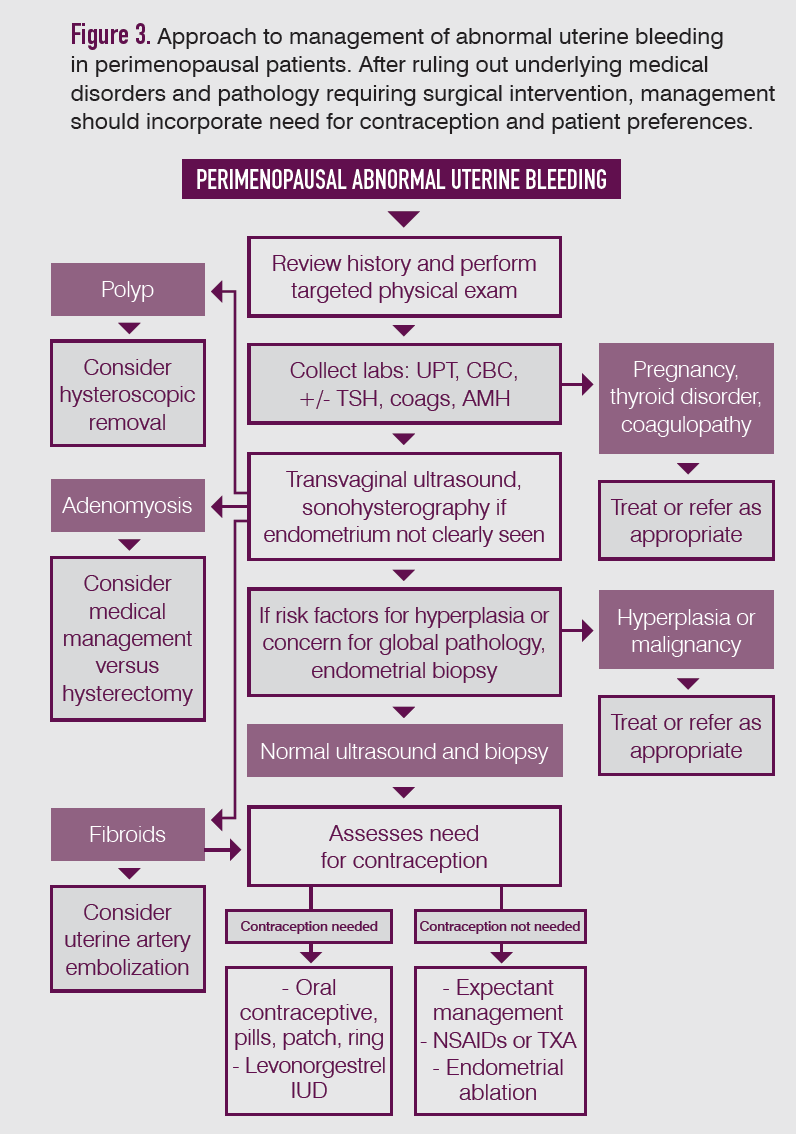
Las causas estructurales del sangrado se evalúan mejor con una ecografía, que también puede orientar la necesidad de una muestra de endometrio para evaluar la hiperplasia o la malignidad. Si es posible, la ecografía realizada 4-6 días después del inicio del sangrado proporcionará la máxima información sobre el endometrio. Si la franja endometrial es irregular o no está claramente identificada, la sonohisterografía puede ayudar a distinguir entre cambios globales y focales.
Por lo general, el muestreo de endometrio debe realizarse en mujeres mayores de 45 años con SUA y en aquellas menores de 45 con antecedentes de exposición a estrógenos sin oposición, factores de riesgo de cáncer de endometrio o tratamiento médico fallido. Una patología focal significativa, como pólipos o miomas submucosos, probablemente se pasará por alto en una biopsia endometrial ciega. La histeroscopia puede estar indicada en casos seleccionados cuando se sospecha o se visualiza fuertemente una enfermedad focal en la ecografía; sin embargo, es más caro e invasivo.
La evaluación del tiempo probable hasta la menopausia puede ser útil cuando se analizan las opciones de tratamiento. Las mujeres que están cerca de la menopausia pueden preferir contemporizar el tratamiento médico para evitar la cirugía, mientras que aquellas para quienes la menopausia es más distante pueden priorizar la eficacia sobre la limitación de los procedimientos invasivos.
Un nivel de hormona anti-Mulleriana (AMH)> 200 ng / mL hace que la menopausia sea muy improbable en los próximos cinco años, independientemente de la edad de la mujer, mientras que un nivel muy bajo de AMH predice la menopausia en el próximo año con un valor predictivo positivo que varía del 51%. a los <48 años al 79% a los 51 años.
Tratamiento. Si se han descartado hiperplasia y malignidad, y el paciente no está anémico, la tranquilidad y la vigilancia son suficientes si el patrón de sangrado no es demasiado molesto.
Administración medica. Los tratamientos hormonales son el pilar del tratamiento médico de la SUA y muchos proporcionan al mismo tiempo un método anticonceptivo fiable.
Los anticonceptivos hormonales combinados (incluidas las píldoras, el anillo vaginal y los parches) son eficaces para controlar muchas etiologías de la SUA y aliviarán los síntomas vasomotores y la sequedad vaginal asociados con la perimenopausia, en particular con dosis prolongadas o continuas. Además, reducen el riesgo de cáncer de endometrio y ovario y pueden mantener o mejorar la densidad mineral ósea.
Sin embargo, los anticonceptivos hormonales que contienen estrógenos aumentan el riesgo de accidente cerebrovascular trombótico e infarto de miocardio, los cuales aumentan en términos de riesgo de fondo con la edad. Las mujeres mayores en edad reproductiva también tienen más probabilidades de tener comorbilidades médicas como hipertensión, obesidad, diabetes y enfermedades cardíacas que pueden contraindicar el uso de dosis anticonceptivas de estrógeno.
Los métodos que contienen solo progestina tienen menos contraindicaciones y riesgos que los métodos que contienen estrógeno y, al mismo tiempo, proporcionan una excelente anticoncepción.
Estos incluyen píldoras de progestina sola, inyectables (acetato de medroxiprogesterona de depósito), implantes que contienen etonogestrel y el sistema intrauterino de levonorgestrel (LNG-IUS). El LNG-IUS y los POP también pueden continuarse hasta la menopausia para brindar protección endometrial a las mujeres que usan estrógeno para tratar los síntomas de la menopausia. Los inconvenientes incluyen la falta de eficacia para los síntomas menopáusicos hipoestrogénicos y un mayor riesgo de patrones de sangrado irregular.
FACTORES DE RIESGO DEL CÁNCER DE ENDOMETRIAL:
- Anovulación crónica (SOP)
- Edad temprana en la menarquia y edad avanzada en la menopausia
- Edad avanzada
- Dieta alta en grasas
- Bajos niveles de actividad física.
- Nuliparidad
- Tumores de ovario secretores de estrógeno (tumores de la granulosa)
- Resistencia a la insulina y diabetes tipo 2
- Historia previa personal de cánceres epiteliales de mama u ovario
- Antecedentes familiares de cánceres de endometrio o epitelio de colon, mama u ovario
- Estrógeno sin oposición o cierto uso de SERM (es decir, tamoxifeno)
- Historia de hiperplasia endometrial
- Radiación pélvica previa
El momento de suspender la anticoncepción hormonal en mujeres perimenopáusicas no es sencillo. Las mujeres que usan LNG-IUS o implantes que contienen etonogestrel pueden experimentar amenorrea antes de la menopausia, y las mujeres que usan anticonceptivos hormonales combinados pueden experimentar hemorragia por deprivación incluso después de la menopausia. La interrupción del tratamiento hormonal para evaluar durante 12 meses la amenorrea, que define a una mujer como menopáusica, la deja en riesgo de un embarazo no deseado.
Para las mujeres que usan anticonceptivos hormonales combinados, se puede tomar una decisión compartida basada en la edad sobre cuándo dejar de tomarlos, teniendo en cuenta los antecedentes familiares de la mujer. Se ha descrito el uso de AMH o FSH (30 UI / l en dos ocasiones con un intervalo de 6 a 8 semanas, medido entre 7 y 14 días después de la interrupción de las hormonas), pero estos métodos bioquímicos no se han validado en poblaciones grandes y diversas de mujeres. y por tanto no puede considerarse definitivo. Las mujeres que usan LNG-IUS pueden comenzar la terapia de reemplazo hormonal (TRH) según sea necesario mientras continúan usando el SIU.
Los análogos de la hormona liberadora de gonadotropina (GnRH) pueden inducir un estado hipogonadal que conduce a la atrofia endometrial.
Los agonistas están disponibles en forma inyectable (acetato de leuprolida) y los antagonistas activos por vía oral más nuevos (elagolix) han sido aprobados recientemente por la FDA para su uso en mujeres con endometriosis. El uso a largo plazo de estos compuestos está limitado por efectos secundarios hipoestrogénicos que incluyen pérdida ósea, síntomas vasomotores y atrofia vaginal, pero pueden ser útiles para ayudar a las mujeres a llegar a la menopausia.
La terapia de "adición" con dosis bajas de noretindrona y estrógeno puede minimizar los efectos secundarios y la desmineralización ósea. Elagolix ahora está disponible en una cápsula combinada con estradiol 1 mg y acetato de noretindrona 0,5 mg. Está aprobado por la FDA para mujeres con fibromas uterinos que tienen sangrado excesivamente abundante.
Para las mujeres con contraindicaciones u objeciones a la terapia hormonal, los AINE programados o el ácido tranexámico pueden reducir significativamente la pérdida de sangre menstrual.
Histeroscopia. Los pólipos uterinos y los fibromas submucosos generalmente se pueden tratar de manera efectiva y eficiente con extirpación histeroscópica. La extracción incompleta y el recrecimiento pueden causar sangrado recurrente. Se ha informado que los pólipos tienen una tasa de incidencia acumulada de hasta el 12% anual; por lo tanto, la SUA recurrente en una mujer previamente tratada por pólipos debe tratarse de manera proactiva
La ablación o resección endometrial proporciona una reducción significativa del sangrado para muchas mujeres, con un tiempo de recuperación más corto y un regreso al trabajo más rápido que la histerectomía, y tasas de satisfacción del paciente comparables.
Sin embargo, aproximadamente el 20% de las mujeres que se someten a ablación endometrial posteriormente se someterán a una histerectomía. La ablación hace que la evaluación posterior del endometrio sea un desafío ya veces imposible, dejando a las mujeres en riesgo de hemorragia posmenopáusica que no puede evaluarse adecuadamente, así como cánceres de endometrio que se presentan tarde debido a la falta de hemorragia.
Embolización de la arteria uterina (EAU) y ecografía focalizada. La EAU es un procedimiento de radiología intervencionista mediante el cual se ocluyen las arterias uterinas, con el objetivo de provocar necrosis fibroma. Los EAU se asocian con una estancia hospitalaria más corta y un retorno más rápido a la actividad completa, pero un mayor riesgo de complicaciones menores en comparación con la histerectomía, 32 y tuvieron puntuaciones de satisfacción y calidad de vida comparables en un estudio aleatorizado.
Entre las que se sometieron a EAU, el 24% se sometió a una histerectomía en el quinto año posoperatorio y el 35% en el décimo. Un ensayo reciente, aleatorizado y controlado de EAU versus ecografía centrada en RM informó resultados similares, aunque EAU tuvo una tasa más baja de reintervención.
Histerectomía. Si bien la histerectomía es el tratamiento definitivo para el sangrado anormal, conlleva un riesgo de complicaciones de aproximadamente el 8%, por lo que es mejor reservarla para pacientes que han fracasado con el tratamiento conservador.

No hay comentarios:
Publicar un comentario